
【题目】碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:
①H2(g) + I2(?)![]() 2HI(g)+9.48kJ
2HI(g)+9.48kJ
②H2(g) + I2(?)![]() 2HI(g)-26.48kJ
2HI(g)-26.48kJ
下列判断正确的是
A.①中的I2为固态,②中的I2为气态
B.②的反应物总能量比①的反应物总能量低
C.①的产物比反应②的产物热稳定性更好
D.1mol 固态碘升华时将吸热17kJ
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】下列卤代烃既能发生消去反应生成烯烃,又能发生水解反应生成醇的是
①![]() ②CH3CH2CH2Br ③CH3F④CH3CH2Br ⑤C(CH3)3CH2Br⑥CH(CH3)2C(CH3)2Br
②CH3CH2CH2Br ③CH3F④CH3CH2Br ⑤C(CH3)3CH2Br⑥CH(CH3)2C(CH3)2Br
A. ①③⑤B. ②④⑥C. ③④⑤D. ①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被誉为第三金属,广泛用于航天航空等领域。硼化钒(VB2)-空气电池的放电反应为4VB2+11O2===4B2O3+2V2O5,以该电池为电源制备钛的装置如图所示。

下列说法正确的是( )
A. 电解过程中,OH-由阴离子交换膜右侧向左侧迁移
B. Pt极反应式为2VB2+22OH--22e-===V2O5+2B2O3+11H2O
C. 电解过程中,铜极附近电解质溶液的pH减小
D. 若石墨极只收集到4.48LCl2气体,则理论上制备4.8gTi
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某条件下,在 2L 密闭容器中发生如下反应:2NO2(g) ![]() 2NO(g)+O2(g)。若反应在三种不同条件下进 行,其中实验 I、II 都在 800℃,实验 III 在 850℃,NO、O2 的起始浓度都为 0 mol/L,NO2 的浓度(mol·L-1) 随时间(min)的变化如图所示,请回答下列问题:
2NO(g)+O2(g)。若反应在三种不同条件下进 行,其中实验 I、II 都在 800℃,实验 III 在 850℃,NO、O2 的起始浓度都为 0 mol/L,NO2 的浓度(mol·L-1) 随时间(min)的变化如图所示,请回答下列问题:
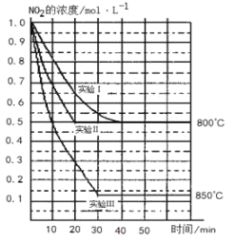
(1)对比实验I、II和III,得出的下列结论中正确的是___________。
A.实验II和实验I相比,可能隐含的反应条件是:反应容器的体积缩小了
B.实验II和实验I相比,可能隐含的反应条件是:使用效率更高的催化剂
C.实验I条件下该反应的平衡常数大于实验III条件下该反应的平衡常数
D.对比实验I和III可知,该反应正反应是吸热反应
(2)若实验I中NO2的起始浓度改为2.0mol·L-1,其它条件不变,则达到平衡时所需用的时间________40min(填“大于”、“等于”或“小于”),NO2的转化率将____(填“增大”、“减小”或“不变”)。
(3)该反应的平衡常数表达式是___________,若实验I达平衡后,再向密闭容器中通入2mol由物质的量之比为1:1组成的NO2与NO混合气体(保持温度不变),则平衡将___________(填“向左”、“向右”或“不”)移动,达到新平衡时,NO2的物质的量浓度为_________mol·L-1。
(4)若改变外界条件,使该反应的平衡常数数值变大,下列说法正确的是_______。
A. 一定向正反应方向移动 B. 在平衡移动时,正反应速率先增大后减小
C. 一定向逆反应方向移动 D. 在平衡移动时,逆反应速率先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们祖先的四大发明之一黑火药的爆炸反应为:S+2KNO3+3C![]() A+N2↑+3CO2↑(已配平)。请回答下列问题:
A+N2↑+3CO2↑(已配平)。请回答下列问题:
(1)生成物固体A属于___________晶体,上述化学反应的氧化剂是__________(写化学式);
(2)硫元素在周期表中的位置为_________能说明氯的非金属性比硫强的实验是_______(任写一条即可);
(3)C原子最外层电子的电子排布式是_____,CCl4是一种常见的有机溶剂,写出其电子式_____,判断其属于_________(填“极性”、“非极性”)共价键_____分子(填“极性”或“非极性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的工业制备原理的方程式书写正确的是
A.氢氧化钠:Na2CO3+Ca(OH)2![]() CaCO3↓+2NaOH
CaCO3↓+2NaOH
B.乙醇:C6H12O6![]() 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑
C.二氧化硫:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D.氯气:Ca(ClO)2+4HCl(浓)![]() CaCl2+2Cl2↑+2H2O
CaCl2+2Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将少量CuSO4粉末溶于盛有水的试管中得到一种天蓝色溶液,先向试管里的溶液中滴加氨水,首先形成蓝色沉淀。继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液;若加入乙醇溶剂,将析出深蓝色的晶体。
(1)溶液中呈天蓝色微粒的结构可用示意图表示为_______,1 mol该天蓝色微粒所含的σ键数目为________。
(2)加入乙醇的作用是__________。
(3)写出蓝色沉淀溶解成深蓝色溶液的离子方程式______________。
(4)得到的深蓝色晶体是[Cu(NH3)4]SO4·H2O,晶体中Cu2+与NH3之间的化学键称为_____,提供空轨道的微粒是_______,提供孤电子对的成键原子是_____,该晶体中配体分子的VSEPR模型为_______。
(5)下列说法正确的是_________
a.[Cu(NH3)4]SO4组成元素中电负性最大的是氮元素
b.氨气分子和水分子的空间构型不同,氨气分子的键角大于水分子的键角
c.氨气极易溶于水,是因为氨气分子和水分子之间形成2种不同的氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关 2个电化学装置的叙述正确的是 ( )
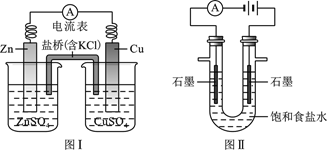
A.图I,由于盐桥中的![]() 移向
移向![]() 溶液,一段时间后,使溶液中的正电荷数量增加
溶液,一段时间后,使溶液中的正电荷数量增加
B.图I,在不改变总反应的前提下,可用![]() 替换
替换![]() ,用石墨替换 Cu棒
,用石墨替换 Cu棒
C.图II,通电后![]() 和
和![]() 先从阳极区移动到阴极,然后阴极才发生反应
先从阳极区移动到阴极,然后阴极才发生反应![]()
D.图II,通电后,由于 ![]() 向阳极迁移,导致阳极附近 pH升高
向阳极迁移,导致阳极附近 pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S16O2与18O2在高温条件下发生反应2SO2+O2![]() 2SO3,达到化学平衡后,平衡混合物中含18O的微粒( )
2SO3,达到化学平衡后,平衡混合物中含18O的微粒( )
A. 只有SO3 B. 只有SO2、SO3 C. 有SO2、SO3、O2 D. 只有O2、SO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com