
【题目】下列物质的工业制备原理的方程式书写正确的是
A.氢氧化钠:Na2CO3+Ca(OH)2![]() CaCO3↓+2NaOH
CaCO3↓+2NaOH
B.乙醇:C6H12O6![]() 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑
C.二氧化硫:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D.氯气:Ca(ClO)2+4HCl(浓)![]() CaCl2+2Cl2↑+2H2O
CaCl2+2Cl2↑+2H2O
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素。Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的电子总数与X、W原子的电子总数之比为5:4。下列说法正确的是( )
A.原子半径:W>Z>Y>X
B.Y的简单气态氢化物的热稳定性比Z的强
C.由X、Z组成的化合物与由Z、W组成的化合物只能发生化合反应
D.由X、Y、Z三种元素组成的化合物可以是酸、碱或盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用所学知识探究Na2O2与H2能否反应,设计了如下装置图,回答下列问题:
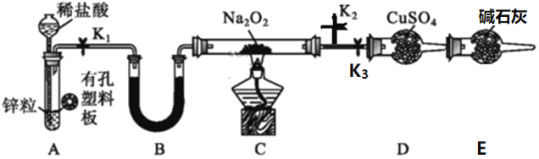
(1)装置A的气密性的检查方法是_______;A中发生反应的离子方程式为____________。
(2)Na2O2的电子式为_______________。装置中装硫酸铜固体的仪器名称是__________。装置B中盛放的试剂名称为__________。
(3)装置E的作用是_____________。
(4)实验中涉及到下列操作,其正确的顺序是____________。
①关闭K2,打开K1、K3,点燃C处酒精灯 ②在K2出口处收集一小试管气体验纯
③关闭K3,打开K1、K2 ④装置冷却后关闭K1 ⑤熄灭C处酒精灯
(5)若观察到D处干燥管中固体变蓝,则C中发生反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:
①H2(g) + I2(?)![]() 2HI(g)+9.48kJ
2HI(g)+9.48kJ
②H2(g) + I2(?)![]() 2HI(g)-26.48kJ
2HI(g)-26.48kJ
下列判断正确的是
A.①中的I2为固态,②中的I2为气态
B.②的反应物总能量比①的反应物总能量低
C.①的产物比反应②的产物热稳定性更好
D.1mol 固态碘升华时将吸热17kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F代表6种元素。请填写下列空白。
(1) A元素基态原子的最外层电子数是内层电子数的3倍,其原子结构示意图为____,位于元素周期表中第________周期第________族。
(2) B元素的负一价离子和C元素的正一价离子的电子层结构都与Ne相同,B的原子半径_____ C的原子半径(填“>”或“<”)。
(3) D的基态原子在前四周期元素的基态原子中单电子数最多,D的元素名称为____,其基态原子的电子排布式为_______,有____种运动状态不同的电子。
(4)E元素的正三价离子的3d轨道为半充满,E的元素符号为_____,其基态原子的价电子排布图为____,其正三价离子比正二价离子稳定,原因是_______________。
(5)F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,F的元素符号为_____,在元素周期表中位于______区。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应N2 + 3H2![]() 2NH3,下列判断正确的是( )
2NH3,下列判断正确的是( )
A.3体积H2和足量N2反应,必定生成2体积NH3
B.工业上采用氮氢循环操作的主要目的是提高H2和N2的利用率
C.500℃左右比室温更有利于向合成氨的方向进行
D.其他条件不变,增大压强,平衡必定向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自催化作用是指反应物之一使该 反应速率加快的作用。用稀硫酸酸化的![]() 进行下列三组实验,一段时间后溶液均褪色(
进行下列三组实验,一段时间后溶液均褪色(![]() 可以记做
可以记做![]() )。
)。
实验① | 实验② | 实验③ |
|
|
|
褪色 | 比实验①褪色快 | 比实验①褪色快 |
下列说法不正确的是
A.实验①中发生氧化还原反应,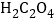 是还原剂,产物MnSO4能起自催化作用
是还原剂,产物MnSO4能起自催化作用
B.实验②褪色比①快,是因为MnSO4的催化作用加快了反应速率
C.实验③褪色比①快,是因为Cl-的催化作用加快了反应速率
D.若用![]() 的
的![]() 做实验①,推测比实验①褪色快
做实验①,推测比实验①褪色快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法正确的是
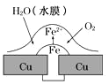
A.阳极电极反应式为:2H++2e→H2↑
B.此过程中铁做负极,被氧化
C.此过程中铜会被腐蚀,发生氧化反应
D.此过程中电子从Fe移向Cu,铁铆钉发生还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com