
����Ŀ��A��B��C��D��E��F����6��Ԫ�ء�����д���пհס�
(1) AԪ�ػ�̬ԭ�ӵ��������������ڲ��������3������ԭ�ӽṹʾ��ͼΪ____��λ��Ԫ�����ڱ��е�________���ڵ�________�塣
(2) BԪ�صĸ�һ�����Ӻ�CԪ�ص���һ�����ӵĵ��Ӳ�ṹ����Ne��ͬ��B��ԭ�Ӱ뾶_____ C��ԭ�Ӱ뾶������>������<������
(3) D�Ļ�̬ԭ����ǰ������Ԫ�صĻ�̬ԭ���е���������࣬D��Ԫ������Ϊ____�����̬ԭ�ӵĵ����Ų�ʽΪ_______����____���˶�״̬��ͬ�ĵ��ӡ�
(4)EԪ�ص����������ӵ�3d���Ϊ�������E��Ԫ�ط���Ϊ_____�����̬ԭ�ӵļ۵����Ų�ͼΪ____�������������ӱ������������ȶ���ԭ����_______________��
(5)FԪ�ػ�̬ԭ�ӵ�M��ȫ������N��û�гɶԵ��ӣ�ֻ��һ��δ�ɶԵ��ӣ�F��Ԫ�ط���Ϊ_____����Ԫ�����ڱ���λ��______����
���𰸡�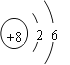 �� ��A < �� 1s22s22p63s23p63d54s1��[Ar]3d54s1 24 Fe
�� ��A < �� 1s22s22p63s23p63d54s1��[Ar]3d54s1 24 Fe 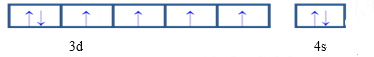 Fe3+��3d���Ϊ���������ϵ������ͣ����ȶ� Cu ds
Fe3+��3d���Ϊ���������ϵ������ͣ����ȶ� Cu ds
��������
(1)����ԭ�Ӻ�����Ӳ��Ͼ��еĵ�������ϵȷ��ԭ���������ɵ�ԭ�ӽṹʾ��ͼ���ٽ��ԭ�ӽṹ��Ԫ��λ�õĹ�ϵȷ�������ڵ����ڼ���������
(2)ԭ��ʧȥ�����γ������ӣ���õ����γ������ӣ�ԭ�Ӻ�����Ӳ���Խ�࣬ԭ�Ӱ뾶��Խ��
(3)���� D�����ڱ���λ�ü�����������ԭ���ͺ��ع����ж�DԪ�أ�Ȼ���Ϲ���ԭ���ɵ����̬ԭ�Ӻ�������Ų�ʽ�������õ�������˶�״̬�ĵ�����Ŀ��
(4)Ԫ�ص�ԭ��ʧȥ�������Ӿ��γ������������ӣ�ԭ�Ӻ�����ӣ������ߵ���ʧȥ�����EԪ�ص����ӵĵ��Ӳ�ṹ�ж�EԪ�أ�ԭ�Ӻ���������Ǿ����ܳɵ����У���������������ͬ�����������ͣ��ȶ���ԭ�Ӻ����������ĵ��Ӵ���ȫ����������ȫ��ʱ�ȶ���
(5)���ݹ���ԭ�����Fԭ�ӵĸ������Ӳ��Ϻ��еĵ��ӹ�ϵ�ж�Ԫ�����ƣ��ٸ���ԭ�ӽṹ��Ԫ��λ�õĹ�ϵ�ж��������ڱ���������
(1)AԪ�ػ�̬ԭ�ӵ��������������ڲ��������3������A��������Ų�Ϊ2��6����8��OԪ�أ�����ԭ�ӽṹʾ��ͼΪ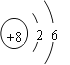 ������ԭ�Ӻ�����Ӳ�����������������������������������������������֪OԪ��λ��Ԫ�����ڱ��еڶ����ڵ�VIA�壻
������ԭ�Ӻ�����Ӳ�����������������������������������������������֪OԪ��λ��Ԫ�����ڱ��еڶ����ڵ�VIA�壻
(2)ԭ��ʧȥ�����γ������ӣ���õ����γ������ӡ�BԪ�صĸ�һ�����Ӻ�CԪ�ص���һ�����ӵĵ��Ӳ�ṹ����Ne��ͬ����B��FԪ�أ�C��NaԪ�أ�Fλ�ڵڶ����ڣ�Naλ�ڵ������ڣ�����ԭ�Ӻ�����Ӳ���Խ�࣬ԭ�Ӱ뾶��Խ������ԭ�Ӱ뾶F<Na��
(3)D�Ļ�̬ԭ����ǰ������Ԫ�صĻ�̬ԭ���е���������࣬˵��D��Ԫ������Ϊ��Ԫ�أ����̬ԭ�ӵĵ����Ų�ʽΪ1s22s22p63s23p63d54s1��Ҳ��дΪ[Ar]3d54s1��������ͬһԭ���в����ܴ����˶�״̬��ȫ��ͬ���������ӣ�����24��CrԪ�ص�ԭ�Ӻ�����24���˶�״̬��ͬ�ĵ��ӣ�
(4)EԪ��ʧȥ3���������������ӣ��Ҹ����ӵ�3d���Ϊ���������E��ԭ������Ϊ26��E��Ԫ�ط���ΪFe�����̬ԭ�ӵļ۵����Ų�ͼΪ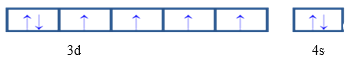 ������Feԭ��ʧȥ3�������γɵ�Fe3+��3d���Ϊ��������ȶ�״̬����ϵ������ͣ��ȶ�����ʧȥ2������ʱ3d����ϲ��ǰ���״̬�����Fe3+��Fe2+�ȶ���
������Feԭ��ʧȥ3�������γɵ�Fe3+��3d���Ϊ��������ȶ�״̬����ϵ������ͣ��ȶ�����ʧȥ2������ʱ3d����ϲ��ǰ���״̬�����Fe3+��Fe2+�ȶ���
(5)FԪ�ػ�̬ԭ�ӵ�M��ȫ������N��û�гɶԵ��ӣ�ֻ��һ��δ�ɶԵ��ӣ���Fԭ�ӵĺ�������Ų�ʽ��1s22s22p63s23p63d104s1��ԭ��������29������F��Ԫ����Cu��CuԪ����Ԫ�����ڱ���λ��ds����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ƣ�Na2S2O3�������������Լ������Լ�����ԭ�������ȼ��ȡ�
��ʵ�����Ʊ����������װ��ͼ���¡�

��1������B��������________��
��2��д��װ��B�Ʊ�Na2S2O3�Ļ�ѧ��Ӧ����ʽ____________________________��
��3��NaOH��Һ��������____________________________________��
�������������Ʒ���Ȳ�������
�ٳ�ȡ�����Ƶ������������Ʒ8.0g���250mL��Һ
�ڴӢ�����ȡ20.00mL��Һ����ƿ��
����0.lmol��L-1����Һ�ζ���ʵ������������
�ζ�ǰ������mL�� | �ζ��������mL�� | ����Һ�����mL�� | |
ʵ��һ | 1.20 | 21.00 | 20.00 |
ʵ��� | 0.40 | 19.20 | 20.00 |
ʵ���� | 0.50 | x | 20.00 |
��4���õζ�ʱ������ƿ�м���1��2�ε���Һ��ָʾ������ﵽ�ζ��յ���жϱ���______________��
��5��x������ͼ��ʾ����x=________��������������ݼ���������������Ʒ����Ϊ_______________������֪I2+2Na2S2O3=2NaI+Na2S4O6��
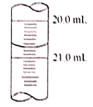
��6�������������ȡ20.00mL�����������Һʱ��δ�������������Һ��ϴ�ζ��ܣ�������Ʒ�Ĵ��Ƚ�______________���ƫ��ƫС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ�е�Ԫ�ؼ��仯�����ת����ϵ���ش����⣺
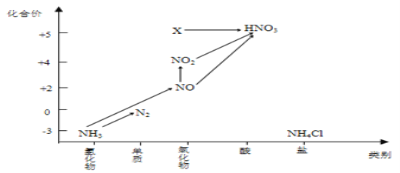
(1)��ͼ���á�______�ͺ���Ԫ�ص�_____���о��������ʵ�������Ҫ�Ƕȡ�������
(2)ʵ���ҳ���NH4Cl��Ca(OH)2��ȡ�������÷�Ӧ�Ļ�ѧ����ʽΪ________��
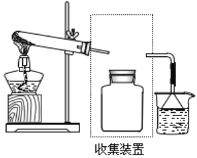
(3)��Ҫ�ռ�һƿ���������ں����ϰ�ͼ���������װ��ͼ��ȫ�IJ��ֻ�����_____
![]()
(4)��ҵ����NH3��������ˮΪԭ����������Ĺ������̼�ͼ��ͼ��ʾ��
![]()
д��NH3��NO�Ļ�ѧ����ʽ__________________________________��
(5)ͼ�У�X�Ļ�ѧʽΪ_______����Xת��ΪHNO3����______________��Ӧ(����������ԭ��������������ԭ��)��Ӧ��
(6)��Ҫ��NH3��N2����ԭ���Ͽ��������Լ����е���________(�����)��
A��O2 B��Na C��NH4Cl D��NO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ⶨijNaOH��Һ�����ʵ���Ũ�ȣ�����0.100mol/L��HCl����Һ�����к͵ζ����ü�����ָʾ������ ��ش��������⣺
��1���ζ�ǰ������Һ����ȡ����NaOH��Һ�� _____�У� ���������ƣ���������2~3��ָʾ����
��2��ʢװ���������������Ϊ _____ ��
��3������жϵζ��յ㣨��д����ɫ�仯�� __________ ��
ijѧ����������ƽ��ʵ�飬���ݼ�¼���£�
ѡȡ�����������ݣ��������NaOH��Һ�����ʵ���Ũ��Ϊ _______________��
��������λ��Ч���֣�
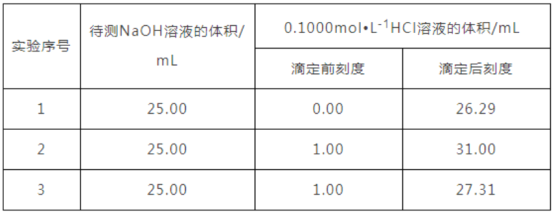
��4��������Щ������ʹ�ⶨ���ƫ��____________
a����Ӧ����������ˮϴ����δ�ô���Һ��ϴ
b���ζ�ǰ��ƽ�Ӷ������ζ������Ӷ���
c���ζ�ǰ�����������ݣ��ζ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵĹ�ҵ�Ʊ�ԭ���ķ���ʽ��д��ȷ����
A.�������ƣ�Na2CO3+Ca(OH)2![]() CaCO3��+2NaOH
CaCO3��+2NaOH
B.�Ҵ���C6H12O6![]() 2C2H5OH+2CO2��
2C2H5OH+2CO2��
C.��������Cu+2H2SO4��Ũ��![]() CuSO4+SO2��+2H2O
CuSO4+SO2��+2H2O
D.������Ca(ClO)2+4HCl��Ũ��![]() CaCl2+2Cl2��+2H2O
CaCl2+2Cl2��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��M��Q��R��Ϊǰ20��Ԫ�أ���ԭ�Ӱ뾶����Ҫ���ϼ۵Ĺ�ϵ��ͼ��ʾ������˵��������

A. Qλ�ڵ�������IA��
B. X��Y��Z����Ԫ����ɵĻ�����������λ��
C. �����Ӱ뾶��M->Q+>R2+
D. Z��M������������Ӧˮ�����Ϊǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β������������ӦΪ2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H��0������˵����ȷ����
N2(g)+2CO2(g) ��H��0������˵����ȷ����
A. �����¶ȿ�ʹ�÷�Ӧ������Ӧ���������淴Ӧ���ʼ�С
B. ����ѹǿ������ʹNO��CO��ȫתΪΪ����Ⱦ��N2��CO2����������Ⱦ
C. �÷�Ӧ��Ӧ��������С��������������
D. ʹ�ø�Ч�����ɽ��ͷ�Ӧ�Ļ�ܣ��������Ӱٷ�������Ӧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪֱ����Դ���ϡNa2SO4ˮ��Һ��װ�á�ͨ�����ʯī�缫a��b�����ֱ�μӼ���ʯ����Һ������ʵ������������ȷ����

A. �ݳ�����������a�缫��С��b�缫��
B. һ�缫�ݳ���ζ���壬��һ�缫�ݳ��̼�������
C. a�缫�����ʺ�ɫ��b�缫��������ɫ
D. a�缫��������ɫ��b�缫�����ʺ�ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڲ��������У���¯��ԭ�Ϸ�������Ҫ��ӦΪ��2Na2CO3+CaCO3+3SiO2![]() 2Na2SiO3+CaSiO3+3CO2����
2Na2SiO3+CaSiO3+3CO2����
(1)ij��Ӧ��������״̬�²����磬������______���塣
(2)������Ӧ�����漰�Ķ�����Ԫ��ԭ�Ӱ뾶�ɴ�С��˳��Ϊ________��
(3)̼������ͬ��Ԫ�أ�����Ԫ�ص�ԭ���������ӵļ۲���ӱ�ʾʽΪ________��
(4)дһ���ܱȽ�̼Ԫ�غ���Ԫ�طǽ�����ǿ���Ļ�ѧ��Ӧ����ʽ��________��
(5)CO2�ĵ���ʽΪ_______��
(6)��Ӧ��Na2CO3��CaCO3�����Ʊ�������̼�������������Ƕ���ʹ��ϡ���ᣬ��˵�����ɡ�______
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com