
【题目】硫代硫酸钠(Na2S2O3)可用作分析试剂、基准试剂、还原剂、除氯剂等。
Ⅰ、实验室制备硫代硫酸钠装置图如下。

(1)仪器B的名称是________。
(2)写出装置B制备Na2S2O3的化学反应方程式____________________________。
(3)NaOH溶液的作用是____________________________________。
Ⅱ、测硫代硫酸钠样品纯度步骤如下
①称取Ⅰ中制得硫代硫酸钠样品8.0g配成250mL溶液
②从①中量取20.00mL溶液于锥形瓶中
③用0.lmol·L-1标准碘液滴定,实验测得数据如下
滴定前读数(mL) | 滴定后读数(mL) | 待测液体积(mL) | |
实验一 | 1.20 | 21.00 | 20.00 |
实验二 | 0.40 | 19.20 | 20.00 |
实验三 | 0.50 | x | 20.00 |
(4)该滴定时,向锥形瓶中加入1至2滴淀粉液作指示剂,则达到滴定终点的判断标准是______________。
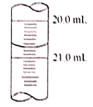
(5)x读数如图所示,则x=________,根据所测的数据计算该硫代硫酸钠样品纯度为_______________。(已知I2+2Na2S2O3=2NaI+Na2S4O6)
(6)若步骤①中量取20.00mL硫代硫酸钠溶液时,未用硫代硫酸钠溶液润洗滴定管,则测得样品的纯度将______________(填“偏大”或“偏小”)。
【答案】三颈烧瓶 2Na2S+Na2CO3+4SO2 =3Na2S2O3+CO2 吸收多余的SO2 滴加最后一滴标准液后,溶液由无色变为蓝色且半分钟内不变色 20.70 98.75%或98.8% 偏小
【解析】
Ⅰ、(1)依据仪器构造作答;
(2)装置A中制备出的二氧化硫通入装置B中,此装置硫化钠与碳酸钠和通入的二氧化硫发生氧化还原反应生硫代硫酸钠,根据氧化还原反应规律与质量守恒定律书写其化学方程式;
(3)氢氧化钠可吸收二氧化硫;
Ⅱ、(4)淀粉溶液遇碘单质变蓝,据此分析;
(5)滴定管读数时,凹液面的最低处与刻度线相切,且要估读一位;根据实验数据得出消耗的碘液的体积,结合关系式I2~2S2O32-,得出样品中S2O32-的物质的量,进而计算样品的纯度;
(6)依据滴定实验操作不当可能带来的误差分析结果。
Ⅰ、(1)仪器B的名称为三颈烧瓶,
故答案为:三颈烧瓶;
(2)在装置B中利用Na2S、Na2CO3与SO2制备Na2S2O3,此反应为氧化还原反应,-2价的S元素升高到+2价,+4价的S元素降低到+2价,依据氧化还原反应规律配平该化学方程式为:2Na2S+Na2CO3+4SO2 =3Na2S2O3+CO2,
故答案为:2Na2S+Na2CO3+4SO2 =3Na2S2O3+CO2;
(3)NaOH溶液可吸收多余的SO2,防止污染环境,
故答案为:吸收多余的SO2;
Ⅱ、(4)根据给定的已知反应I2+2Na2S2O3=2NaI+Na2S4O6可知,硫代硫酸钠会使碘单质变成碘离子,则滴定时向锥形瓶中加入1至2滴淀粉液作指示剂,当滴加最后一滴标准液后,溶液由无色变为蓝色且半分钟内不变色,则证明达到滴定终点,
故答案为:滴加最后一滴标准液后,溶液由无色变为蓝色且半分钟内不变色;
(5)根据滴定管的读数规则可知,实验三滴定后读数为20.70mL,则三次实验得出消耗的标准碘液的体积分别为21.00 mL -1.20 mL =19.80mL、19.20 mL -0.40mL =18.80mL、20.70 mL -0.50 mL =20.20 mL,则可以看出第二实验误差太大,实验数据应该舍去,由此可知消耗的碘液的体积平均值为=![]() ,结合化学方程式,根据关系式I2~2S2O32-可得,则配制的20mL样品溶液中硫代硫酸钠的物质的量n=2n(I2)= 2×0.lmol·L-1×20.00×10-3L=4.00×10-3 mol,则原样品中含有的硫代硫酸钠的物质的量为4.00×10-3 mol ×
,结合化学方程式,根据关系式I2~2S2O32-可得,则配制的20mL样品溶液中硫代硫酸钠的物质的量n=2n(I2)= 2×0.lmol·L-1×20.00×10-3L=4.00×10-3 mol,则原样品中含有的硫代硫酸钠的物质的量为4.00×10-3 mol ×![]() =5×10-2 mol,所以样品纯度为
=5×10-2 mol,所以样品纯度为![]() ,
,
故答案为:20.70;98.75%或98.8%;
(6)待测的滴定管未用硫代硫酸钠溶液润洗,会使锥形瓶内待测液浓度偏低,消耗的碘液体积偏小,最终导致样品纯度偏小,
故答案为:偏小。


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】CuCl2溶液有时呈黄色,有时呈绿色或蓝色,这是因为在CuCl2的水溶液中存在如下平衡:
[Cu(H2O)4]2++4Cl-![]() [CuCl4]2-+4H2O
[CuCl4]2-+4H2O
蓝色 绿色
欲使溶液由绿色变为蓝色,可采用的方法是( )
A. 加NaCl溶液B. 加水C. 加AgNO3溶液D. 加NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是M、N两种主族元素的原子结构示意图,下列说法正确的是( )
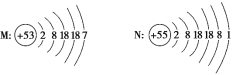
A.M位于第五周期Ⅶ族
B.N位于IA族,该主族中的元素又称为碱金属元素
C.N在空气中燃烧,生成化学式为N2O的氧化物
D.M所在的主族中各元素是同周期元素中非金属性最强的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向25℃时,体积均为20mL浓度均为0.1mol·L-1的两种酸HX、HY溶液中分別滴加0.1mol·L-1的NaOH溶液所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是
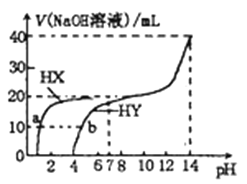
A. HX、HY均为弱酸
B. Ka(HY)的数量级约为10-6
C. b点时:2c(Na+)=c(Y-)+c(HY)
D. V(NaOH)=20mL时,反应后的两种溶液中c(X-)=c(Y-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素。Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的电子总数与X、W原子的电子总数之比为5:4。下列说法正确的是( )
A.原子半径:W>Z>Y>X
B.Y的简单气态氢化物的热稳定性比Z的强
C.由X、Z组成的化合物与由Z、W组成的化合物只能发生化合反应
D.由X、Y、Z三种元素组成的化合物可以是酸、碱或盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要配制100mL、10molL-1的NaCl溶液,试回答下列各题:
(1)经计算,应该用托盘天平称取NaCl固体___g。
(2)配制溶液时一般可分为以下几个步骤:①称量②计算③定容④移液⑤洗涤⑥溶解其正确的操作顺序为(填编号)___。
(3)容量瓶上需标有以下5项中的___
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
A.①②④ B.③⑤⑥ C.①③⑤ D.②④⑥
(4)若用NaCl固体配制溶液,下列仪器中,不需要用到的是___。(填序号)
A.蒸发皿 B.100mL容量瓶 C.烧杯 D.胶头滴管 E.药匙 F.托盘天平 G.玻璃棒
(5)下列错误操作会导致所得溶液偏低的是___(多项,填序号)。
A.定容时仰视容量瓶刻度线区
B.容量瓶中原有少量蒸馏水
C.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
D.配制好溶液后,容量瓶未塞好,酒出一些溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质之间通过一步反应能实现如图所示转化关系,且与表中条件也匹配的是( )
选项 | X | Y | Z | 箭头上为反应条件或试剂 |
|
A | Fe | FeCl2 | FeCl3 | ①通入少量Cl2 | |
B | Na2CO3 | NaCl | NaHCO3 | ②先通CO2,再通过量NH3 | |
C | MgO | MgCl2 | Mg(OH)2 | ③加热 | |
D | NaAlO2 | Al(OH)3 | Al2O3 | ④加水 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F代表6种元素。请填写下列空白。
(1) A元素基态原子的最外层电子数是内层电子数的3倍,其原子结构示意图为____,位于元素周期表中第________周期第________族。
(2) B元素的负一价离子和C元素的正一价离子的电子层结构都与Ne相同,B的原子半径_____ C的原子半径(填“>”或“<”)。
(3) D的基态原子在前四周期元素的基态原子中单电子数最多,D的元素名称为____,其基态原子的电子排布式为_______,有____种运动状态不同的电子。
(4)E元素的正三价离子的3d轨道为半充满,E的元素符号为_____,其基态原子的价电子排布图为____,其正三价离子比正二价离子稳定,原因是_______________。
(5)F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,F的元素符号为_____,在元素周期表中位于______区。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com