
【题目】如图是M、N两种主族元素的原子结构示意图,下列说法正确的是( )
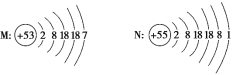
A.M位于第五周期Ⅶ族
B.N位于IA族,该主族中的元素又称为碱金属元素
C.N在空气中燃烧,生成化学式为N2O的氧化物
D.M所在的主族中各元素是同周期元素中非金属性最强的元素
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为验证卤素单质氧化性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
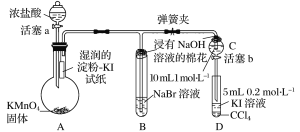
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ. ……
(1)盛放浓盐酸的仪器名称为____________________。
(2)在烧瓶内发生反应时,体现浓盐酸的性质为__________________。
(3)验证氯气的氧化性强于碘的实验现象是__________________________。
(4)B中溶液发生反应的离子方程式是____________________________。
(5)浸有NaOH溶液的棉花的作用为______________________________。
(6)为验证溴的氧化性强于碘,过程Ⅳ的操作步骤和现象是______________。
(7)过程Ⅲ实验的目的是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三效催化剂是最为常见的汽车尾气催化剂,其催化剂表面物质转化的关系如图所示,下列说法正确的 ( )
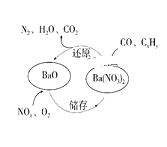
A.在转化过程中,氮元素均被还原
B.依据图示判断催化剂不参与储存和还原过程
C.还原过程中生成0.1mol N2,转移电子数为0.5 NA
D.三效催化剂能有效实现汽车尾气中CO、CxHy、NOx三种成分的净化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法正确的组合是( )
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、H2O、H2S晶体的熔点依次降低
④离子化合物中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2-相紧邻
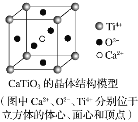
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠溶于水时离子键被破坏
A. ①②③⑥B. ①②④C. ③⑤⑦D. ③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍及其化合物的应用正日益被重视。
(1)最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子价电子的排布图为_______。
(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有_____(填字母)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液pH均小于7
(3)铍、铝晶体都是由金属原子密置层在三维空间堆积而成(最密堆积)。铍的熔点(1551K)比铝的熔点(930K)高,原因是____。
(4)氯化铍在气态时存在BeCl2分子(a)和二聚分子(BeCl2)2(b),固态时则具有如下图所示的链状结构(c)。
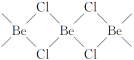
①a属于____(填“极性”或“非极性”)分子。
②二聚分子(BeCl2)2中Be原子的杂化方式相同,且所有原子都在同一平面上。b的结构式为____(标出配位键)。
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所:
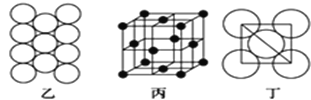
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为___个;Al晶体的密度为_____(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)和铜(Cu)在生产生活中有广泛的应用。硒可以用作光敏材料、电解锰行业的催化剂,也是动物体必需的营养元素和对植物有益的营养元素等。氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下所示:
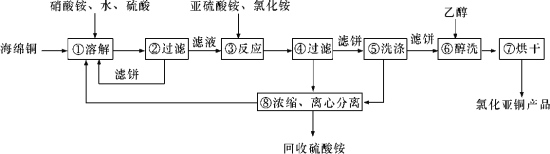
请回答下列问题:
(1)若步骤①中得到的氧化产物只有一种,则它的化学式是____________。
(2)写出步骤③中主要反应的离子方程式:_________。
(3)步骤⑤包括用pH=2的溶液酸洗、水洗两步操作,酸洗采用的酸是_______(写酸的名称)。
(4)上述工艺中,步骤⑥和⑦的作用是__________。
(5)Se为ⅥA族元素,用乙二胺四乙酸铜阴离子水溶液和硒代硫酸钠(Na2SeSO3)溶液反应可获得纳米硒化铜,硒代硫酸钠还可用于Se的精制,写出硒代硫酸钠(Na2SeSO3)与H2SO4溶液反应得到精硒的化学方程式:______________。
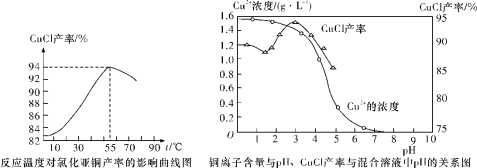
(6)氯化亚铜产率与温度、溶液pH关系如下图所示。据图分析,流程化生产氯化亚铜的过程中,温度过低影响CuCl产率的原因是_________;温度过高、pH过大也会影响CuCl产率的原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率、化学反应限度的说法中,正确的是( )
A.反应C(s)+H2O(g)![]() CO(g)+H2(g),增加碳的用量可加快反应速率
CO(g)+H2(g),增加碳的用量可加快反应速率
B.用铁片与稀硫酸反应制H2,改用 98%的浓硫酸可加快生成H2的速率
C.反应2SO2(g)+O2(g)![]() 2SO3(g)在密闭容器中进行,压缩容器体积,反应速率增大
2SO3(g)在密闭容器中进行,压缩容器体积,反应速率增大
D.可逆反应达到化学平衡状态时,正、逆反应的速率相等且都为0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)可用作分析试剂、基准试剂、还原剂、除氯剂等。
Ⅰ、实验室制备硫代硫酸钠装置图如下。

(1)仪器B的名称是________。
(2)写出装置B制备Na2S2O3的化学反应方程式____________________________。
(3)NaOH溶液的作用是____________________________________。
Ⅱ、测硫代硫酸钠样品纯度步骤如下
①称取Ⅰ中制得硫代硫酸钠样品8.0g配成250mL溶液
②从①中量取20.00mL溶液于锥形瓶中
③用0.lmol·L-1标准碘液滴定,实验测得数据如下
滴定前读数(mL) | 滴定后读数(mL) | 待测液体积(mL) | |
实验一 | 1.20 | 21.00 | 20.00 |
实验二 | 0.40 | 19.20 | 20.00 |
实验三 | 0.50 | x | 20.00 |
(4)该滴定时,向锥形瓶中加入1至2滴淀粉液作指示剂,则达到滴定终点的判断标准是______________。
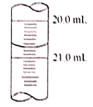
(5)x读数如图所示,则x=________,根据所测的数据计算该硫代硫酸钠样品纯度为_______________。(已知I2+2Na2S2O3=2NaI+Na2S4O6)
(6)若步骤①中量取20.00mL硫代硫酸钠溶液时,未用硫代硫酸钠溶液润洗滴定管,则测得样品的纯度将______________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
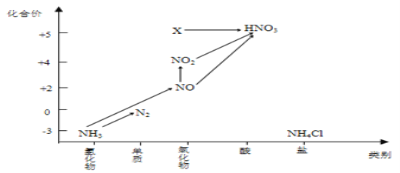
【题目】依据图中氮元素及其化合物的转化关系,回答问题:
(1)该图利用“______和核心元素的_____是研究物质性质的两个重要角度”建立。
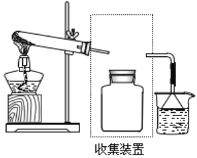
(2)实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为________。
(3)若要收集一瓶氨气,请在横线上把图虚框内连接装置图不全的部分画出。_____
![]()
(4)工业上以NH3、空气、水为原料生产硝酸的工艺流程简图如图所示:
![]()
写出NH3→NO的化学方程式__________________________________。
(5)图中,X的化学式为_______,将X转化为HNO3属于______________反应(填“氧化还原”或“非氧化还原”)反应。
(6)若要将NH3→N2,从原理上看,下列试剂可行的是________(填序号)。
A.O2 B.Na C.NH4Cl D.NO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com