
【题目】某化学课外兴趣小组为验证卤素单质氧化性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
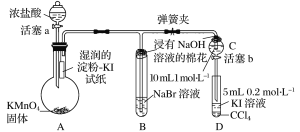
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ. ……
(1)盛放浓盐酸的仪器名称为____________________。
(2)在烧瓶内发生反应时,体现浓盐酸的性质为__________________。
(3)验证氯气的氧化性强于碘的实验现象是__________________________。
(4)B中溶液发生反应的离子方程式是____________________________。
(5)浸有NaOH溶液的棉花的作用为______________________________。
(6)为验证溴的氧化性强于碘,过程Ⅳ的操作步骤和现象是______________。
(7)过程Ⅲ实验的目的是________________________________。
【答案】分液漏斗 还原性和酸性 湿润的淀粉KI试纸变蓝 Cl2+2Br-=Br2+2Cl- 吸收挥发出来的Cl2,防止污染空气 打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置后CCl4层变为紫红色 确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰
【解析】
装置A:高锰酸钾溶液和浓盐酸反应生成氯化锰、氯化钾、氯气和水,装置A中生成氯气,烧瓶上端湿润的碘化钾淀粉试纸变蓝色,验证氯气的氧化性强于碘;装置B:装置B中盛有溴化钠,氯气进入装置B中,氯气氧化溴离子为溴单质,溶液呈橙红色,验证氯的氧化性强于溴,氯气有毒,能被氢氧化钠吸收,浸有氢氧化钠的棉花防止氯气污染空气;当B和C中的溶液都变为黄色时,夹紧弹簧夹,为验证溴的氧化性强于碘,实验时应避免氯气的干扰,当B中溶液由黄色变为棕红色时,说明有大量的溴生成,此时应关闭活塞a,否则氯气过量,影响实验结论。
(1)根据装置图可知盛放浓盐酸的仪器名称为分液漏斗;
(2)在烧瓶内发生反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,在该反应中Cl元素的化合价由反应前HCl中的-1价变为反应后Cl2中的0价,化合价升高,失去电子,HCl表现还原性,作还原剂;还有一部分Cl元素化合价反应前后没有发生变化,与反应产生的金属阳离子结合形成盐,起酸的作用,所以该反应中浓盐酸体现了还原性和酸性;
(3)在A上部的湿润kI淀粉试纸上发生反应:Cl2+2I-=I2+2Cl-,I2能使淀粉变蓝,根据氧化剂的氧化性大于氧化产物的氧化性,可知Cl2的氧化性大于I2的氧化性,反应现象是湿润的淀粉KI试纸变蓝;
(4)因Cl2的氧化性大于Br2的氧化性,根据氧化剂的氧化性大于氧化产物的氧化性,可发生:Cl2+2Br-=Br2+2Cl-;
(5)氯气有毒,能被氢氧化钠吸收,浸有氢氧化钠的棉花的作用是吸收挥发出来的Cl2,防止氯气污染空气;
(6)因Br2的氧化性大于I2的氧化性,根据氧化剂的氧化性大于氧化产物的氧化性,要发生:Br2+2I-=I2+2Br-,过程IV的操作和现象是打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D震荡,静置后CCl4层溶液变为紫红色;
(7)为验证溴的氧化性强于碘,实验时应避免氯气的干扰,当B中溶液由黄色变为棕红色时,说明有大量的溴生成,此时应关闭活塞a,否则氯气过量,影响实验结论,过程III实验的目的是确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学向一定体积的Ba(OH)2溶液中逐渐加入稀硫酸,并测得混合溶液的导电能力随时间变化的曲线如图所示。该小组的同学关于如图的下列说法中,不正确的是( )
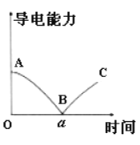
A.AB段溶液的导电能力不断减弱,说明生成的BaSO4不是电解质
B.B处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子
C.BC段溶液的导电能力不断增大,主要是由于过量的H2SO4电离出的离子导电
D.a时刻Ba(OH)2溶液与稀硫酸恰好完全中和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.23 g钠的原子最外层电子数为2NAB.1 L 0.1 mol·L-1乙酸溶液中H+数为0.1NA
C.标准状况下,22.4 L乙烷的分子数为NAD.1 mol羟基所含电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2,则关于该反应体系说法错误的是
A.该反应的化学方程式为2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O
B.该反应中的氧化剂是H2O2,还原产物是O2
C.氧化性:H2CrO4>O2
D.如反应转移了0.3 rnol电子,则产生的气体在标准状况下体积为3.36 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒液流电池充电时间短,续航能力强,其充放电原理为VO2+(蓝色)+V3+(绿色)+H2O ![]() VO2+(黄色)+V2+(紫色)+2H+。以此电池为电源,用石墨电极电解Na2SO3溶液,可得到NaOH 和H2SO4示意图如下。下列说法错误的是( )
VO2+(黄色)+V2+(紫色)+2H+。以此电池为电源,用石墨电极电解Na2SO3溶液,可得到NaOH 和H2SO4示意图如下。下列说法错误的是( )
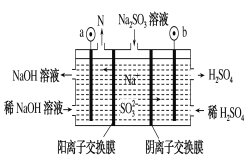
A. 全钒液流电池放电时,正极的电极反应式为: VO2++2H++e-===VO2++H2O
B. 图中a电极为阴极,N物质是H2
C. 钒液流电池充电时,阳极附近溶液由绿色逐渐变为紫色
D. 电解时,b电极的反应式为: SO32-+H2O-2e-===SO42-+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学教师为“氯气与金属钠反应”设计了如图装置的实验。实验操作:先给钠预热,等钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述中错误的是( )

A. 反应生成的大量白烟是氯化钠晶体
B. 玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气
C. 钠着火燃烧产生苍白色火焰
D. 若在棉花球外沿滴一滴石蕊溶液,可根据其颜色变化判断氯气是否被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是高中阶段学习的五种物质,单质A在单质B中燃烧产生苍白色的火焰,产物溶于水得到常见的强酸。化合物C、D是刚学过的两种有重要用途的物质,化合物C具有强氧化性、漂白性,是单质B与水反应的产物之一。化合物D是淡黄色物质,可用于呼吸面具,可由E与氧气燃烧得到。回答下列问题:
(1)化学式A: ________;B:________;C:________;D:________;E:________;
(2)单质A与单质B反应的化学方程式: _______________。
(3)E与氧气燃烧反应的化学方程式: _________________。
(4)D用于呼吸面具中,发生反应的化学方程式: ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl2溶液有时呈黄色,有时呈绿色或蓝色,这是因为在CuCl2的水溶液中存在如下平衡:
[Cu(H2O)4]2++4Cl-![]() [CuCl4]2-+4H2O
[CuCl4]2-+4H2O
蓝色 绿色
欲使溶液由绿色变为蓝色,可采用的方法是( )
A. 加NaCl溶液B. 加水C. 加AgNO3溶液D. 加NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是M、N两种主族元素的原子结构示意图,下列说法正确的是( )
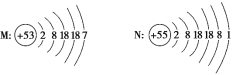
A.M位于第五周期Ⅶ族
B.N位于IA族,该主族中的元素又称为碱金属元素
C.N在空气中燃烧,生成化学式为N2O的氧化物
D.M所在的主族中各元素是同周期元素中非金属性最强的元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com