
【题目】A、B、C、D、E是高中阶段学习的五种物质,单质A在单质B中燃烧产生苍白色的火焰,产物溶于水得到常见的强酸。化合物C、D是刚学过的两种有重要用途的物质,化合物C具有强氧化性、漂白性,是单质B与水反应的产物之一。化合物D是淡黄色物质,可用于呼吸面具,可由E与氧气燃烧得到。回答下列问题:
(1)化学式A: ________;B:________;C:________;D:________;E:________;
(2)单质A与单质B反应的化学方程式: _______________。
(3)E与氧气燃烧反应的化学方程式: _________________。
(4)D用于呼吸面具中,发生反应的化学方程式: ____________。
【答案】H2 Cl2 HClO Na2O2 Na H2+ Cl2![]() 2HCl 2Na+O2
2HCl 2Na+O2 ![]() Na2O2 2Na2O2+2CO2=2Na2CO3+O2或2Na2O2+2H2O=4NaOH+O2↑
Na2O2 2Na2O2+2CO2=2Na2CO3+O2或2Na2O2+2H2O=4NaOH+O2↑
【解析】
单质A在单质B中燃烧产生苍白色的火焰,产物溶于水得到常见的强酸,则A为H2, B为Cl2,Cl2和水反应生成盐酸和次氯酸,次氯酸具有强氧化性、漂白性,则C为HClO;化合物D是淡黄色物质,可用于呼吸面具,则D为Na2O2,Na2O2可由活泼金属E (Na)在氧气中燃烧得到,据以上分析解答。
单质A在单质B中燃烧产生苍白色的火焰,产物溶于水得到常见的强酸,则A为H2, B为Cl2,Cl2和水反应生成盐酸和次氯酸,次氯酸具有强氧化性、漂白性,则C为HClO;化合物D是淡黄色物质,可用于呼吸面具,则D为Na2O2,Na2O2可由活泼金属E (Na)在氧气中燃烧得到,
(1)结合以上分析可知,A、B、C、D、E分别为:H2、Cl2、HClO、Na2O2、Na;
故答案为:H2;Cl2;HClO;Na2O2; Na;
(2)单质A与单质B反应的化学方程式即为H2在Cl2中燃烧的化学方程式为:H2+ Cl2![]() 2HCl ;
2HCl ;
故答案为:H2+ Cl2![]() 2HCl;
2HCl;
(3)E与氧气燃烧反应的化学方程式即为钠在点燃的条件下与氧气反应:2Na+O2 ![]() Na2O2;
Na2O2;
故答案为:2Na+O2 ![]() Na2O2;
Na2O2;
(4)D用于呼吸面具中,发生反应的化学方程式即为过氧化钠与水或二氧化碳反应,2Na2O2+2CO2=2Na2CO3+O2或2Na2O2+2H2O=4NaOH+O2↑;
故答案为:2Na2O2+2CO2=2Na2CO3+O2或2Na2O2+2H2O=4NaOH+O2↑。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】利用下列装置可以制备无水氯化铁。下列有关说法不正确的是( )
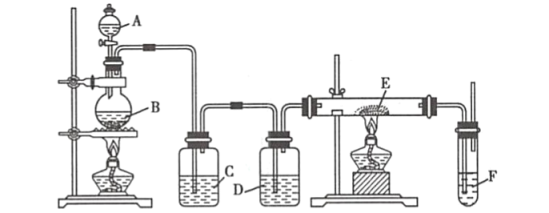
A.烧瓶B中制备氯气的反应物为二氧化锰和浓盐酸
B.装置C、D中分别盛有饱和食盐水和浓硫酸
C.装置D和装置E之间需要增加一个干燥装置,才能制得无水氯化铁
D.装置F的目的是吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,B和酸性气体D反应能生成C,A露置在空气中足够长时间也会变为C,E与D反应也能生成C,A、B都能与水反应生成E。回答下列问题:
(1)写出下列物质的化学式: B________,C________,D________,E________。
(2)写出下列反应的化学方程式:
①A生成B:____________________;
②B与水反应生成E:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为验证卤素单质氧化性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
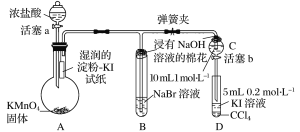
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ. ……
(1)盛放浓盐酸的仪器名称为____________________。
(2)在烧瓶内发生反应时,体现浓盐酸的性质为__________________。
(3)验证氯气的氧化性强于碘的实验现象是__________________________。
(4)B中溶液发生反应的离子方程式是____________________________。
(5)浸有NaOH溶液的棉花的作用为______________________________。
(6)为验证溴的氧化性强于碘,过程Ⅳ的操作步骤和现象是______________。
(7)过程Ⅲ实验的目的是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡酸钠可用于制造陶瓷电容器的基体、颜料和催化剂。以锡锑渣(主要含Sn、Sb、As、Pb的氧化物)为原料,制备锡酸钠的工艺流程图如下图所示:
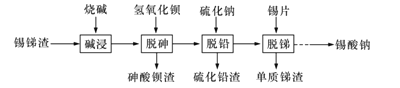
请回答下列问題:
(1)Sn(IVA)、As(VA)、Sb(VA)三种元素中,Sn的原子序数为50,其原子结构示意图为_____,碱浸”时SnO2发生反应的化学方程式为___________________________。
(2)“碱浸”时,若Sn元素氧化物中SnO含量较高,工业上则加入NaNO3,其作用是_______。
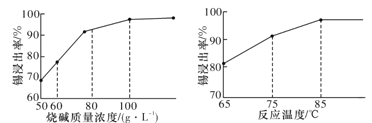
(3)从溶液中得到锡酸钠晶体的实验操作是_________、趁热过滤、洗涤、干燥。下图是“碱浸”实验的参数,请选择“碱浸”的合适条件_______。
(4)“脱铅”是从含Na2PbO2的溶液中形成硫化铅渣,其离子方程式为_________________。
(5)“脱锑”时Na2SbO4发生的化学方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下的HCl气体8.96L溶于水形成100ml溶液,然后与足量的铁屑充分反应。计算:
(1)所得盐酸的物质的量浓度_______
(2)标准状况下生成H2的体积_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂锰电池结构如图所示,其中电解质![]() 溶于混合有机溶剂中,
溶于混合有机溶剂中,![]() 通过电解质迁移入
通过电解质迁移入![]() 晶格中生成
晶格中生成![]() 。下列有关说法正确的是
。下列有关说法正确的是
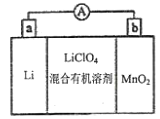
A. 外电路电流方向:a→b
B. 电池正极反应式为:![]()
C. 可以用水代替电池中的混合有机溶剂
D. 用该电池给铅蓄电池充电,a极与Pb电极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三效催化剂是最为常见的汽车尾气催化剂,其催化剂表面物质转化的关系如图所示,下列说法正确的 ( )
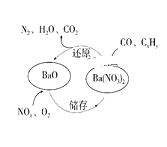
A.在转化过程中,氮元素均被还原
B.依据图示判断催化剂不参与储存和还原过程
C.还原过程中生成0.1mol N2,转移电子数为0.5 NA
D.三效催化剂能有效实现汽车尾气中CO、CxHy、NOx三种成分的净化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率、化学反应限度的说法中,正确的是( )
A.反应C(s)+H2O(g)![]() CO(g)+H2(g),增加碳的用量可加快反应速率
CO(g)+H2(g),增加碳的用量可加快反应速率
B.用铁片与稀硫酸反应制H2,改用 98%的浓硫酸可加快生成H2的速率
C.反应2SO2(g)+O2(g)![]() 2SO3(g)在密闭容器中进行,压缩容器体积,反应速率增大
2SO3(g)在密闭容器中进行,压缩容器体积,反应速率增大
D.可逆反应达到化学平衡状态时,正、逆反应的速率相等且都为0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com