
【题目】利用下列装置可以制备无水氯化铁。下列有关说法不正确的是( )
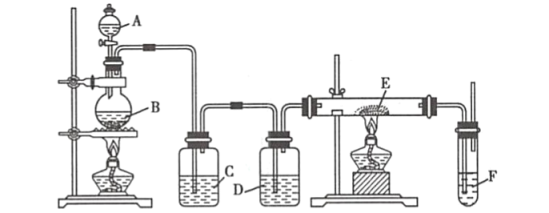
A.烧瓶B中制备氯气的反应物为二氧化锰和浓盐酸
B.装置C、D中分别盛有饱和食盐水和浓硫酸
C.装置D和装置E之间需要增加一个干燥装置,才能制得无水氯化铁
D.装置F的目的是吸收尾气
【答案】C
【解析】
由装置图可知圆底烧瓶中发生的是实验室制备氯气的反应,C中呈放的是饱和食盐水,吸收反应是挥发出的HCl,D中盛放的是浓硫酸,用于干燥氯气,E中放置的是铁粉,在双通管中生成无水氯化铁。
A. 实验室制备氯气用二氧化锰和浓盐酸,因此烧瓶B中制备氯气的反应物为二氧化锰和浓盐酸,A项正确,不符合题意;
B. C中呈放的是饱和食盐水,吸收反应时挥发出的HCl,D中盛放的是浓硫酸,用于干燥氯气,B项正确,不符合题意;
C. 装置E和装置F之间需要增加一个干燥装置,才能制得无水氯化铁,C项错误,符合题意;
D. 氯气是大气污染物,因此装置F的目的是吸收反应中多余的氯气防止污染空气,D项正确;
答案选C。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料。
①以尿素为原料在一定条件下发生反应:
CO(NH2)2(s)+H2O(l)![]() 2NH3(g)+CO2(g)△H=+133.6 kJ/mol。关于该反应的下列说法正确的是______(填序号)。
2NH3(g)+CO2(g)△H=+133.6 kJ/mol。关于该反应的下列说法正确的是______(填序号)。
a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度可使尿素的转化率增大
d. 达到平衡后,缩小容器的体积,平衡向逆反应方向移动,达新平衡时NH3的浓度大于原平衡
②尿素在一定条件下可将氮的氧化物还原为氮气。
已知:
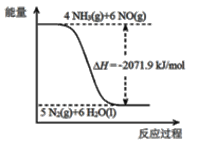
再结合①中的信息,则反应2CO(NH2)2(s)+6NO(g)![]() 5N2(g)+2CO2(g)+4H2O(l)的△H =_______kJ/mol。
5N2(g)+2CO2(g)+4H2O(l)的△H =_______kJ/mol。
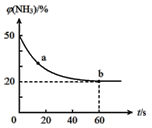
③密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量随时间变化关系如图所示,氨气的平衡转化率为________________。
CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量随时间变化关系如图所示,氨气的平衡转化率为________________。
(2)NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2。已知9.2g NO2和Na2CO3溶液完全反应时转移电子0.1mol,恰好反应后,使溶液中的CO2完全逸出,所得溶液呈弱碱性,则溶液中离子浓度大小关系是c(Na+)>______。
(3)用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度来制备纳米Cu2O,装置如图所示:
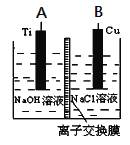
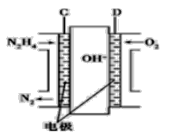
上述装置中阳极反应式为________________________,该电解池中的离子交换膜为________(填“阴”或“阳”)离子交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下(已知2KI+Cl2=2KCl+I2,碘与溴一样易溶于有机溶剂):
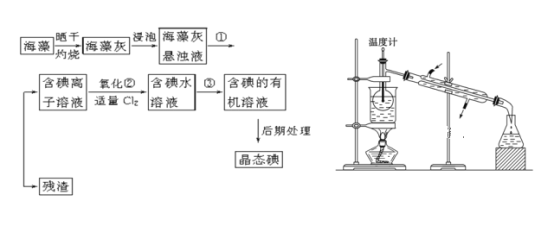
(1)指出提取碘的过程中有关的实验操作名称:①________,③________。
(2)提取碘的过程中,可供选择的有机试剂是________。
A 苯 B 四氯化碳 C 酒精 D 醋酸
(3)为使上述流程中含碘离子溶液转化为碘的有机溶液,实验室里有烧杯、玻璃棒以及必要的夹持仪器,尚缺少的玻璃仪器是___________。
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出上图所示实验装置中的错误之处:
①__________。②_____________。③_________。
(5)进行上述蒸馏操作时使用水浴的原因是__________。
(6)如果本实验用苯做萃取剂,则上层液体的颜色为_______色,下层液体中溶质的主要成分为___________(写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学向一定体积的Ba(OH)2溶液中逐渐加入稀硫酸,并测得混合溶液的导电能力随时间变化的曲线如图所示。该小组的同学关于如图的下列说法中,不正确的是( )
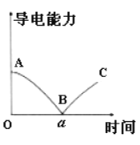
A.AB段溶液的导电能力不断减弱,说明生成的BaSO4不是电解质
B.B处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子
C.BC段溶液的导电能力不断增大,主要是由于过量的H2SO4电离出的离子导电
D.a时刻Ba(OH)2溶液与稀硫酸恰好完全中和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳氧化物的转化有重大用途,回答关于CO和![]() 的问题。
的问题。
![]() 已知:
已知:![]()
![]()
![]()
则![]() 的
的![]() ______
______![]() 用
用![]() 、
、![]() 、
、![]() 表示
表示![]() 。
。
![]() 对于化学平衡
对于化学平衡![]() ,在不同温度下,CO的浓度与反应时间的关系如图所示,由图可得出如下规律:
,在不同温度下,CO的浓度与反应时间的关系如图所示,由图可得出如下规律:
随着温度升高,______、______

![]() 某温度下,将
某温度下,将![]()
![]() 和足量碳充入3L的恒容密闭容器中,发生如下反应:
和足量碳充入3L的恒容密闭容器中,发生如下反应:![]() ,达到平衡时测得
,达到平衡时测得![]() 为平衡常数
为平衡常数![]() ,求平衡时
,求平衡时![]() 的转化率___________?
的转化率___________?![]() 写出计算过程
写出计算过程![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,电解质溶液的性质与变化是多样的,下列说法正确的是( )
A. pH相同的①CH3COONa ②NaClO ③NaOH三种溶液c(Na+)大小:①>②>③
B. 往稀氨水中加水,![]() 的值变小
的值变小
C. pH=4的H2S溶液与pH=10的NaOH溶液等体积混合,存在下列等式:c(Na+)+c(H+)c=(OH—)+2c(S2—)
D. Ca(ClO)2溶液中通入少量CO2,ClO—水解程度增大,溶液碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1mol任何气体的体积都是22.4L
B. 同温同压下两种气体,只要它们的分子数相同,所占体积也一定相同
C. 在标准状况下,体积为22.4L的物质都是1mol
D. 在非标准状况下,1mol任何气体的体积不可能是22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.23 g钠的原子最外层电子数为2NAB.1 L 0.1 mol·L-1乙酸溶液中H+数为0.1NA
C.标准状况下,22.4 L乙烷的分子数为NAD.1 mol羟基所含电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是高中阶段学习的五种物质,单质A在单质B中燃烧产生苍白色的火焰,产物溶于水得到常见的强酸。化合物C、D是刚学过的两种有重要用途的物质,化合物C具有强氧化性、漂白性,是单质B与水反应的产物之一。化合物D是淡黄色物质,可用于呼吸面具,可由E与氧气燃烧得到。回答下列问题:
(1)化学式A: ________;B:________;C:________;D:________;E:________;
(2)单质A与单质B反应的化学方程式: _______________。
(3)E与氧气燃烧反应的化学方程式: _________________。
(4)D用于呼吸面具中,发生反应的化学方程式: ____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com