
【题目】欲测定某NaOH溶液的物质的量浓度,可用0.100mol/L的HCl标准溶液进行中和滴定(用甲基橙作指示剂)。 请回答下列问题:
(1)滴定前,用移液管量取待测NaOH溶液于 _____中( 填仪器名称),并加入2~3滴指示剂;
(2)盛装标准盐酸的仪器名称为 _____ ;
(3)如何判断滴定终点(需写出颜色变化) __________ ;
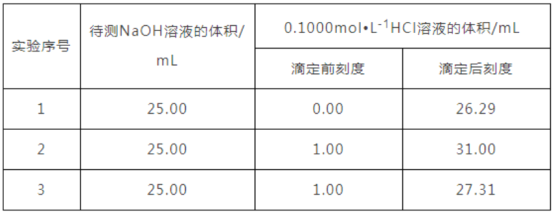
某学生做了三组平行实验,数据记录如下:
选取下述合理数据,算出待测NaOH溶液的物质的量浓度为 _______________;
(保留四位有效数字)
(4)下列哪些操作会使测定结果偏低____________
a.反应容器用蒸馏水洗净后,未用待测液润洗
b.滴定前,平视读数;滴定后,仰视读数
c.滴定前,尖嘴无气泡;滴定后,尖嘴出现气泡
【答案】锥形瓶 酸式滴定管 溶液由黄色变成橙色,且30秒内不变回黄色 0.1052mol/L c
【解析】
根据酸碱中和滴定的步骤和滴定原理进行分析判断即可。
(1)用0.100mol/L的HCl标准溶液对未知浓度的NaOH溶液进行中和滴定,NaOH溶液为待测溶液,应盛装在锥形瓶中;答案:锥形瓶。
(2)盐酸溶液为标准溶液,应盛装在酸式滴定管中;答案:酸式滴定管。
(3)在本次滴定实验中,采用甲基橙作指示剂,当到达滴定终点时,滴入最后一滴盐酸,锥形瓶中的溶液由黄色变为橙色且半分钟内不褪色。答案:溶液由黄色变成橙色,且30秒内不变回黄色。
(4)三组实验中,消耗标准溶液盐酸的体积分别为26.29 mL、30.00mL、26.31mL,观察数据可知,第二组实验误差较大,应舍去,故消耗HCl标准溶液的平均体积为(26.31mL+26.29mL)/2=26.30mL,待测NaOH溶液的物质的量浓度为:c(NaOH)=v(HCl)·c(HCl)/v(NaOH)=26.30mL×0.100mol/L/25.00mL=0.1052mol/L。
(5)a.反应容器指的是锥形瓶,用蒸馏水洗净后,未用待测液润洗,不会影响测定结果,故不会偏低;
b.滴定前平视读数,滴定后仰视读数体积读大了,使消耗的体积偏大,测定结果偏高;
c.滴定前尖嘴无气泡;滴定后尖嘴出现气泡使测定消耗的体积变小了,导致测定结果偏低。
故答案选c。


科目:高中化学 来源: 题型:
【题目】向25℃时,体积均为20mL浓度均为0.1mol·L-1的两种酸HX、HY溶液中分別滴加0.1mol·L-1的NaOH溶液所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是
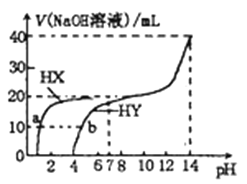
A. HX、HY均为弱酸
B. Ka(HY)的数量级约为10-6
C. b点时:2c(Na+)=c(Y-)+c(HY)
D. V(NaOH)=20mL时,反应后的两种溶液中c(X-)=c(Y-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质之间通过一步反应能实现如图所示转化关系,且与表中条件也匹配的是( )
选项 | X | Y | Z | 箭头上为反应条件或试剂 |
|
A | Fe | FeCl2 | FeCl3 | ①通入少量Cl2 | |
B | Na2CO3 | NaCl | NaHCO3 | ②先通CO2,再通过量NH3 | |
C | MgO | MgCl2 | Mg(OH)2 | ③加热 | |
D | NaAlO2 | Al(OH)3 | Al2O3 | ④加水 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Cu+HNO3 ———— Cu(NO3)2+NO↑+4H2O反应中,
(1) ______ 元素被氧化, ______ 是氧化剂;
(2) ______ 是氧化产物, ______ 发生氧化反应;
(3)被还原的HNO3与参加反应的HNO3物质的量之比是 ______;
(4)用双线桥标出该反应电子转移的方向和数目:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O _____________________________________;
(5)当有8mol HNO3被还原时,反应转移___________个电子;
(6)写出该反应的离子反应方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F代表6种元素。请填写下列空白。
(1) A元素基态原子的最外层电子数是内层电子数的3倍,其原子结构示意图为____,位于元素周期表中第________周期第________族。
(2) B元素的负一价离子和C元素的正一价离子的电子层结构都与Ne相同,B的原子半径_____ C的原子半径(填“>”或“<”)。
(3) D的基态原子在前四周期元素的基态原子中单电子数最多,D的元素名称为____,其基态原子的电子排布式为_______,有____种运动状态不同的电子。
(4)E元素的正三价离子的3d轨道为半充满,E的元素符号为_____,其基态原子的价电子排布图为____,其正三价离子比正二价离子稳定,原因是_______________。
(5)F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,F的元素符号为_____,在元素周期表中位于______区。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作和现象所得结论正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向某无色溶液中滴加稀盐酸 | 溶液变浑浊 | 原溶液中一定存在 |
B | 向某无色溶液中滴加稀NaOH溶液 | 未观察到明显现象 | 原溶液中一定不存在 |
C | 向酸性 | 溶液紫红色褪去 |
|
D | 向某溶液中通入 | 溶液变红 | 原溶液中一定含有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
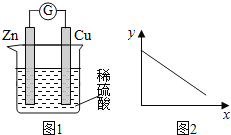
A. 铜棒的质量 B. c(Zn2+) C. c(H+) D. c(SO42-) -
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com