
【题目】钛被誉为第三金属,广泛用于航天航空等领域。硼化钒(VB2)-空气电池的放电反应为4VB2+11O2===4B2O3+2V2O5,以该电池为电源制备钛的装置如图所示。

下列说法正确的是( )
A. 电解过程中,OH-由阴离子交换膜右侧向左侧迁移
B. Pt极反应式为2VB2+22OH--22e-===V2O5+2B2O3+11H2O
C. 电解过程中,铜极附近电解质溶液的pH减小
D. 若石墨极只收集到4.48LCl2气体,则理论上制备4.8gTi
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】在20世纪90年代末期,科学家发现并证明碳有新的单质形态C60存在。后来人们又相继得到了C70、C76、C90、C94等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家庭。下列有关说法错误的是( )
A. 金刚石、C60、C70、管状碳和洋葱状碳都不能与H2发生加成反应
B. 已知C(石墨,s)===C(金刚石,s) ΔH>0,则石墨比金刚石稳定
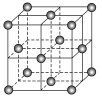
C. C60晶体结构如图所示,每个C60分子周围与它最近且等距离的C60分子有12个
D. 熔点比较:C60<C70<C90<金刚石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于价电子构型3s23p4的描述正确的是( )
A. 它的元素符号为O
B. 它的核外电子排布式为1s22s22p63s23p4
C. 常温下,可以与H2化合生成液态化合物
D. 其电子排布图为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化钠是重要的化工原料,大多采用无水芒硝(Na2SO4)—炭粉还原法制备,原理为:Na2SO4+2CNa2S+2CO2↑。其主要流程如下:
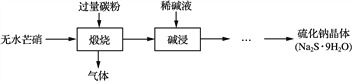
(1) 上述流程中采用稀碱液比用热水更好,理由是________________________________________________________________________。
(2) 已知:I2+2S2O32-===2I-+S4O62-。所制得的Na2S·9H2O晶体中含有Na2S2O3·5H2O等杂质。为测定产品的成分,进行下列实验,步骤如下:
a. 取试样10.00 g配成500.00 mL溶液。
b. 取所配溶液25.00 mL于碘量瓶中,加入过量ZnCO3悬浊液除去Na2S后,过滤,向滤液中滴入2~3滴淀粉溶液,用0.050 00 mol·L-1 I2溶液滴定至终点,用去5.00 mL I2溶液。
c. 再取所配溶液25.00 mL于碘量瓶中,加入50.00 mL 0.050 00 mol·L-1的I2溶液,并滴入2~3滴淀粉溶液,振荡。用标准Na2S2O3溶液滴定多余的I2,用去15.00 mL 0.100 0 mol·L-1 Na2S2O3溶液。
①步骤b中用ZnCO3除去Na2S的离子方程式为____________。
②判断步骤c中滴定终点的方法为______________。
③计算试样中Na2S·9H2O和Na2S2O3·5H2O的质量分数,写出计算过程__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证浓硫酸和木炭粉在加热条件下产生的气体产物,某同学选用了如图所示的实验装置。下列说法错误的是
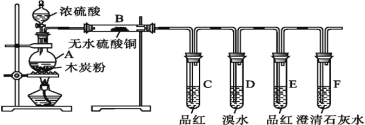
A.B装置用来检验产物中是否有水蒸气生成
B.C装置用来检验产物中是否有SO2生成
C.D装置中溴水褪色,则说明SO2具有漂白性
D.F装置用来检验产物中是否有CO2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用所学知识探究Na2O2与H2能否反应,设计了如下装置图,回答下列问题:
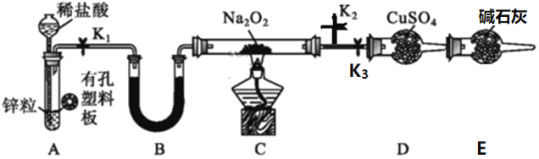
(1)装置A的气密性的检查方法是_______;A中发生反应的离子方程式为____________。
(2)Na2O2的电子式为_______________。装置中装硫酸铜固体的仪器名称是__________。装置B中盛放的试剂名称为__________。
(3)装置E的作用是_____________。
(4)实验中涉及到下列操作,其正确的顺序是____________。
①关闭K2,打开K1、K3,点燃C处酒精灯 ②在K2出口处收集一小试管气体验纯
③关闭K3,打开K1、K2 ④装置冷却后关闭K1 ⑤熄灭C处酒精灯
(5)若观察到D处干燥管中固体变蓝,则C中发生反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知图一表示的是可逆反应 CO(g)+H2(g)![]() C(s)+H2O(g)-Q(Q>0)的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g)-Q(Q>0)的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)![]() N2O4(g)+Q(Q>0)的浓度(c)随时间 t 的变化情况,下列 说法中正确的是
N2O4(g)+Q(Q>0)的浓度(c)随时间 t 的变化情况,下列 说法中正确的是
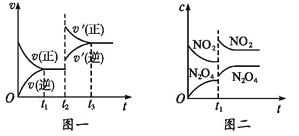
A.图一 t2 时刻改变的条件可能是升高了温度或增大了压强
B.图一 t2 时刻改变的条件可能是通入了 CO 气体
C.图二 t1 时刻改变的条件可能是升高了温度或增大了压强
D.图二 t1 时刻改变的条件是增大压强,则混合气体的平均相对分子质量将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:
①H2(g) + I2(?)![]() 2HI(g)+9.48kJ
2HI(g)+9.48kJ
②H2(g) + I2(?)![]() 2HI(g)-26.48kJ
2HI(g)-26.48kJ
下列判断正确的是
A.①中的I2为固态,②中的I2为气态
B.②的反应物总能量比①的反应物总能量低
C.①的产物比反应②的产物热稳定性更好
D.1mol 固态碘升华时将吸热17kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如下图所示的转化关系:
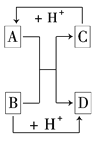
(1)如果A、B、C、D均是10电子的粒子,请写出:
A的电子式_____________;D的电子式____________;
(2)如果A和C是18电子的粒子,B和D是10电子的粒子,请写出:
①A与B在溶液中反应的离子方程式:____________________________________
②根据上述离子方程式,可判断C与B结合质子的能力大小是(用化学式或离子符号表示)________>________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com