
【题目】下列关于价电子构型3s23p4的描述正确的是( )
A. 它的元素符号为O
B. 它的核外电子排布式为1s22s22p63s23p4
C. 常温下,可以与H2化合生成液态化合物
D. 其电子排布图为![]()
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法正确的是

A. Q的氧化物一定含有离子键和共价键 B. 最高价含氧酸的酸性:Z<Y
C. P的最低价氢化物常温常压下为液体 D. Y形成的化合物种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]![]() 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
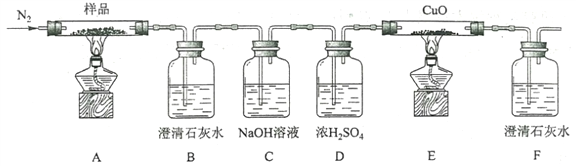
①通入氮气的目的是________________________________________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有___________、___________。
③为防止倒吸,停止实验时应进行的操作是_____________________________。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:________________。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃既能发生消去反应生成烯烃,又能发生水解反应生成醇的是
①![]() ②CH3CH2CH2Br ③CH3F④CH3CH2Br ⑤C(CH3)3CH2Br⑥CH(CH3)2C(CH3)2Br
②CH3CH2CH2Br ③CH3F④CH3CH2Br ⑤C(CH3)3CH2Br⑥CH(CH3)2C(CH3)2Br
A. ①③⑤B. ②④⑥C. ③④⑤D. ①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用乙烯与甲苯为主要原料,按下列路线可合成有机物E、F:

已知:![]()
请回答:
(1)B中官能团的名称是_________,反应⑥的反应类型是__________。
(2)F的结构简式___________________________。
(3)D→E的化学方程式_________________________________。
(4)下列有关说法不正确的是_________。
A.E能与新制的Cu(OH)2悬浊液发生反应,而B不能与新制的Cu(OH)2悬浊液发生反应
B.![]() 不能使酸性KMnO4溶液褪色
不能使酸性KMnO4溶液褪色
C.1molE和足量H2反应,最多消耗4molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y在周期表中的相对位置如图所示,且已知X基态原子的价电子排布为nsnnpn+1,下列说法不正确的是( )
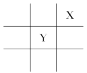
A. X元素的电负性大于YB. X元素的第一电离能大于Y
C. X在周期表中位于第二周期第ⅢA族D. 原子半径Mg>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列书写的离子方程式中,正确的是( )。
A. 酸性高锰酸钾溶液与乙二酸(草酸)反应:2MnO![]() +5C2O
+5C2O![]() +16H+===2Mn2++10CO2↑+8H2O
+16H+===2Mn2++10CO2↑+8H2O
B. 在NH4HSO4溶液中缓慢滴入含等物质的量的NaOH的溶液:NH![]() +OH-===NH3·H2O
+OH-===NH3·H2O
C. VO2+与酸性高锰酸钾溶液反应:5VO2++MnO![]() +H2O===5VO
+H2O===5VO![]() +Mn2++2H+
+Mn2++2H+
D. FeI2溶液中滴入过量溴水:2Fe2++2I-+2Br2===2Fe3++I2+4Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被誉为第三金属,广泛用于航天航空等领域。硼化钒(VB2)-空气电池的放电反应为4VB2+11O2===4B2O3+2V2O5,以该电池为电源制备钛的装置如图所示。

下列说法正确的是( )
A. 电解过程中,OH-由阴离子交换膜右侧向左侧迁移
B. Pt极反应式为2VB2+22OH--22e-===V2O5+2B2O3+11H2O
C. 电解过程中,铜极附近电解质溶液的pH减小
D. 若石墨极只收集到4.48LCl2气体,则理论上制备4.8gTi
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将少量CuSO4粉末溶于盛有水的试管中得到一种天蓝色溶液,先向试管里的溶液中滴加氨水,首先形成蓝色沉淀。继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液;若加入乙醇溶剂,将析出深蓝色的晶体。
(1)溶液中呈天蓝色微粒的结构可用示意图表示为_______,1 mol该天蓝色微粒所含的σ键数目为________。
(2)加入乙醇的作用是__________。
(3)写出蓝色沉淀溶解成深蓝色溶液的离子方程式______________。
(4)得到的深蓝色晶体是[Cu(NH3)4]SO4·H2O,晶体中Cu2+与NH3之间的化学键称为_____,提供空轨道的微粒是_______,提供孤电子对的成键原子是_____,该晶体中配体分子的VSEPR模型为_______。
(5)下列说法正确的是_________
a.[Cu(NH3)4]SO4组成元素中电负性最大的是氮元素
b.氨气分子和水分子的空间构型不同,氨气分子的键角大于水分子的键角
c.氨气极易溶于水,是因为氨气分子和水分子之间形成2种不同的氢键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com