
【题目】合成氨是人类科学技术上的一项重大突破,有关合成氨的说法正确的是
A. 升温能提高氢气的转化率
B. 采用20~50 MPa能提高催化剂的效率
C. 使用催化剂能提高NH3的百分含量
D. 循环使用未反应的N2和H2能节约成本
 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1L 0.l mol/L-1 CH3 COOH溶液中加入0.1molCH3COONa固体,溶液中
[c(CH3COO-)·c(H+)]/c(CH3COOH) (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 。
(2)土壤的pH一般在4-9之间。土壤中Na2CO3含量较高,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 ,加入石膏(CaSO4 2H2O)可以使土壤碱性降低,有关反应的化学方程式为
(3)常温下在20ml 0.1mo l·L-1 Na2CO3溶液中逐滴加入0.1mol·L-1 HC1溶液40mL,溶液中含碳元素的各种微粒(CO2)因逸出未画出)物质的量分数随溶液pH变化的情况如图所示。
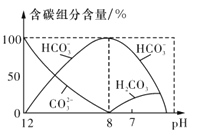
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32- (填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒为 ,溶液中各种离子的物质的量浓度的大小关系
为 ;
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=2×10-4mol·L-1,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH= ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答以下问题:
(1)常温下0.01mol/L HCl溶液由水电离产生的c(H+)与PH=11的CH3COONa溶液中由水电离产生的c(OH-)之比为________。
(2)实验室中配制AgNO3溶液时通常需要向其中加入硝酸目的是______________________;AgCl在水中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq)。25℃时,现将足量AgCl分别放入:①100mL蒸馏水;②100mL 0.2molL-1AgNO3溶液;③100mL 0.1molL-1氯化镁溶液;④100mL 0.1molL-1氯化钠溶液.充分搅拌后,相同温度下Ag+浓度由大到小的顺序是___________________ (填写序号)。
Ag+(aq)+Cl-(aq)。25℃时,现将足量AgCl分别放入:①100mL蒸馏水;②100mL 0.2molL-1AgNO3溶液;③100mL 0.1molL-1氯化镁溶液;④100mL 0.1molL-1氯化钠溶液.充分搅拌后,相同温度下Ag+浓度由大到小的顺序是___________________ (填写序号)。
(3)若浓度均为0.1mol·L-1、等体积的NaOH和NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则m_______n (填“>”“<”或“=”)。
物质的量浓度相同的①NH4Cl,②CH3COONH4,③NH4HSO4,④NH3·H2O四种稀溶液中,NH4+浓度由大到小的顺序是(填序号)_______
25℃时,将0.2mol/L CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合,测得混合溶液PH<7,写出溶液中所有离子浓度的大小顺序__________________________________,此时混合溶液___________(填“促进”或“抑制”)水的电离,溶液中c(CH3COOH)+c(CH3COO—)_______0.1mol/L(填“>”“<”或“=”);若保持温度不变,向体积相同、PH=2的盐酸和醋酸溶液分别加等浓度的氢氧化钠溶液至PH=7,盐酸所需氢氧化钠溶液的体积______醋酸所需氢氧化钠溶液的体积(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水提溴和海带提碘都需要经过浓缩、氧化、提取三个步骤。有关叙述错误的是
A. 提溴的浓缩液来自于海水晒盐后的卤水 B. 氧化步骤都可以通入氯气来实现
C. 提取溴时利用溴的挥发性 D. 提取碘时利用碘的升华特性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草木灰中富含钾盐,主要成分是碳酸钾,还含有少量氯化钾和硫酸钾等。现从某草木灰样品中提取钾盐,并检验其中的![]() 、
、![]() 和Cl。
和Cl。
(1)从草木灰中提取钾盐的实验操作步骤如下,请补充完整:
① ②过滤 ③蒸发浓缩 ④冷却结晶 ⑤过滤。
(2)上述操作中需要用到玻璃棒的是 (填序号)。
(3)将制得的少量晶体加水溶解后,分别置于三支试管中。
①向第一支试管中加入少量稀盐酸,可观察到 ,说明溶液中存在 离子。
②向第二支试管中加入 ,可观察到 ,说明溶液中存在![]() 。
。
③向第三支试管中先加入足量Ba(NO3)2溶液,过滤后,再向滤液中加入足量 溶液,可观察到白色沉淀,说明溶液中存在Cl。其中,加入足量Ba(NO3)2溶液的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 无论乙烯与丙烯酸(CH2=CH-COOH)以何种比例混合,只要二者总物质的量是个定值,完全燃烧时所消耗的氧气也一定是个定值
B. 甘油和甲苯无论以和比例混合,充分燃烧后生成水的质量都不变
C. 保存溴水、煤油均不能使用带橡胶塞的试剂瓶,但其原理并不相同
D. 制备环氧乙烷的反应2CH2=CH2+O2![]() 属于加成反应
属于加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H—H键键能为436 kJ/mol,H-N键键能为391 kJ/mol。根据热化学方程式3H2(g)+N2(g)= 2NH3(g) △H=-92.4kJ/mol,则N≡N键的键能是 ( )
A. 431.4 kJ/mol B. 945.6 kJ/mol
C. 649.6 kJ/mol D. 896.6 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d为离子化合物,其结构中还含非极性共价键,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法正确的是

A. 原子半径:W<X<Y<Z
B. 阴离子的还原性:Y>W
C. 图中物质的转化过程均为氧化还原反应
D. a一定由W、X两种元素组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Na+、Al3+、Fe3+、NO3-、SO42-、Cl-,滴入过量氨水,产生白色沉淀,若溶液中各离子的物质的量浓度相等,则一定存在的离子是
A. SO42- B. NO3- C. Na+ D. Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com