
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1L 0.l mol/L-1 CH3 COOH溶液中加入0.1molCH3COONa固体,溶液中
[c(CH3COO-)·c(H+)]/c(CH3COOH) (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 。
(2)土壤的pH一般在4-9之间。土壤中Na2CO3含量较高,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 ,加入石膏(CaSO4 2H2O)可以使土壤碱性降低,有关反应的化学方程式为
(3)常温下在20ml 0.1mo l·L-1 Na2CO3溶液中逐滴加入0.1mol·L-1 HC1溶液40mL,溶液中含碳元素的各种微粒(CO2)因逸出未画出)物质的量分数随溶液pH变化的情况如图所示。
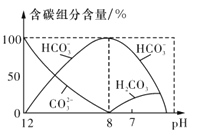
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32- (填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒为 ,溶液中各种离子的物质的量浓度的大小关系
为 ;
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=2×10-4mol·L-1,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH= ;
【答案】(1)不变 c(CH3COO-)+c(OH-)=c(H+)+c(Na+)
(2)CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
Na2CO3+CaSO4·2H2O=CaCO3 ↓+Na2SO4+2H2O
(3)①不能 ②HCO3-、H2CO3 c(Na+)>c(Cl-)>c(HCO3-)>c(H+)=c(OH-) ③10
【解析】
试题分析:(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸根离子浓度增大,醋酸的电离平衡逆向移动,氢离子浓度减小,但[c(CH3COO-)·c(H+)]/c(CH3COOH)=K,K为电离常数,温度不变,常数不变;该溶液中存在的离子只有钠离子、氢离子、氢氧根离子、醋酸根离子,符合电荷守恒,所以该混合溶液中所有离子浓度之间的一个等式为c(CH3COO-)+c(OH-)=c(H+)+c(Na+);
(2)碳酸钠是强碱弱酸盐,碳酸根水解,溶液显碱性,方程式为CO32-+H2O![]() HCO3-+OH-。加入石膏(CaSO4 2H2O)转化为难溶的碳酸钙,因此可以使土壤碱性降低,有关反应的化学方程式为Na2CO3+CaSO4·2H2O=CaCO3 ↓+Na2SO4+2H2O;
HCO3-+OH-。加入石膏(CaSO4 2H2O)转化为难溶的碳酸钙,因此可以使土壤碱性降低,有关反应的化学方程式为Na2CO3+CaSO4·2H2O=CaCO3 ↓+Na2SO4+2H2O;
(3)①由图可知,在同一溶液中,三种H2CO3、HCO3-、CO32-不能大量共存,碳酸根离子离子减少时碳酸氢根离子的浓度逐渐增大,碳酸氢根离子逐渐减少时,碳酸分子的浓度增大;
②由图可知,当pH=7时,部分碳酸氢根离子转化为碳酸,溶液中含碳元素的主要微粒为HCO3-、H2CO3,此时溶液中的溶质为碳酸氢钠、碳酸、氯化钠,且氯化钠的物质的量大于碳酸氢钠的物质的量,因为溶液呈中性,则c(H+)=c(OH-),所以溶液中各离子的浓度关系为c(Na+)>c(Cl-)>c(HCO3-)>c(H+)=c(OH-);
③当溶液中c(HCO3-)∶c(CO32-)=2∶1时,根据Kh=![]() =2×10-4mol·L-1可得c(OH-)= 1×10-4mol·L-1,则c(H+)=1×10-10mol·L-1,所以溶液pH=10。
=2×10-4mol·L-1可得c(OH-)= 1×10-4mol·L-1,则c(H+)=1×10-10mol·L-1,所以溶液pH=10。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】CaH2属于离子化合物,是一种生氢剂,其与水反应的化学方程式为CaH2+2H2O = Ca(OH)2+2H2↑,下列有关CaH2的说法正确的是
A. 其中阴、阳离子个数比为2:1
B. 其中既含离子键又含非极性键
C. 其中氢元素的化合价为+1价
D. 与水反应时,CaH2中的氢元素既被氧化也被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
(1)该蓄电池充电时,发生还原反应的物质是 (填下列字母),放电时生成Fe(OH)2的质量18 g,则外电路中转移的电子数是 。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常把船体与浸在海水里的Zn块相连,或与该蓄电池这样的直流电源的 极(填“正”或“负”)相连。
(3)以该蓄电池做电源,用右图所示装置,在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示)。 。

(4)精炼铜时,粗铜应与直流电源的 极(填“正”或“负”)相连,精炼过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解,甲同学设计如下除杂方案:
![]()
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀时的pH | 2.3 | 7.5 | 5.6 | 6.2 |
完全沉淀时的pH | 3.9 | 9.7 | 6.4 | 8.0 |
则加入H2O2的目的是 ,乙同学认为应将方案中的pH调节到8,你认为此观点 (填“正确”或“不正确”),理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类的生活与生产离不开金属。下列对金属的利用不是由金属的活动性决定的是( )
A. 用铁回收含银废液中的银B. 用锌与稀硫酸反应制取氢气
C. 用金银制作具有保存价值的物品D. 用铝合金制作门窗框架
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
为测定产品纯度,进行了如下实验:准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为:2S2O32+I2==S4O62+2I-

请填写下列空白:
①用标准碘溶液滴定待测溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视____________________。滴定至终点时,溶液颜色________,且半分钟内保持不变,即停止滴定。
②测定起始和终点的液面位置如图,则消耗碘的标准溶液体积为________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________________________________
③下列操作中可能使所测产品的纯度数值偏低的是________(填字母)。
A.酸式滴定管未用标准碘溶液润洗就直接注入标准碘溶液
B.滴定前,锥形瓶用蒸馏水洗涤后,未用待测的溶液润洗就做滴定
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取标准碘溶液体积时,开始仰视读数,滴定结束时俯视读数
E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
(2)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为________,滴定反应的离子方程式为________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有五种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
E | 基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |
请根据表中信息填写:
⑴A元素在元素周期表中的位置____________________________________________。
⑵离子半径:B_________A(填“大于”或“小于”)。
⑶C原子的电子排布图是______________,其原子核外有________个未成对电子,能量最高的电子为________轨道上的电子,其轨道呈________形。
⑷B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的离子方程式为_____________,与D最高价氧化物的水化物水溶液反应的化学方程式为___________。
⑸E元素基态原子的电子排布式为____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,有关合成氨的说法正确的是
A. 升温能提高氢气的转化率
B. 采用20~50 MPa能提高催化剂的效率
C. 使用催化剂能提高NH3的百分含量
D. 循环使用未反应的N2和H2能节约成本
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com