
【题目】CaH2属于离子化合物,是一种生氢剂,其与水反应的化学方程式为CaH2+2H2O = Ca(OH)2+2H2↑,下列有关CaH2的说法正确的是
A. 其中阴、阳离子个数比为2:1
B. 其中既含离子键又含非极性键
C. 其中氢元素的化合价为+1价
D. 与水反应时,CaH2中的氢元素既被氧化也被还原
科目:高中化学 来源: 题型:
【题目】研究发现钼酸钠可减缓金属的腐蚀速率。工业上利用钼精矿(主要成分是不溶于水的MoS2,含少量重金属化合物)制备钼酸钠晶体( Na2MoO4·2H2O)的途径如图所示:

回答下列问题:
Ⅰ.(1)下列标志中,应贴在保存NaClO容器上的是 ___________。

(2)为了提高焙烧效率,除增大空气量外还可以采用的措施有_____________________。
(3)途径①制备钼酸钠溶液,同时有SO42-生成,该反应的离子方程式为_____________。
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是_________________________。
(5)“结晶”前测得部分离子浓度c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L,需加入Ba(OH)2固体除去SO42-。当BaMoO4开始沉淀时,SO42-的去除率为______%。(保留三位有效数字)[已知:Ksp(BaSO4)=1.1×10-10、Ksp(BaMoO4)=4.0×10-8,加入Ba(OH)2固体引起溶液体积变化可忽略]。

Ⅱ.(1)碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是_____。
(2)若缓释剂钼酸钠-月桂酰肌氨酸总浓度为300mgL-1,则缓蚀效果最好时钼酸钠的物质的量浓度为_________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由Zn、Fe、Al、Mg四种金属中的两种组成的混合物6g,与足量的盐酸反应产生的氢气在标况下为2.24升,则混合物中一定含有的金属是
A. Zn B. Fe C. Al D. Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为1.0 mol·L-1的NH3·H2O和NH4Cl混合溶液10 mL,测得其pH为9.3。下列有关叙述正确的是( )
A. 加入适量的NaCl,可使c(NH![]() )=c(Cl-)
)=c(Cl-)
B. 滴加几滴浓氨水,c(NH![]() )减小
)减小
C. 滴加几滴浓盐酸,![]() 的值减小
的值减小
D. 1.0 mol·L-1的NH4Cl溶液中c(NH![]() )比该混合溶液中的大
)比该混合溶液中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚![]() ) ,同时利用此装置的电能在铁上镀铜。,下列说法正确的是
) ,同时利用此装置的电能在铁上镀铜。,下列说法正确的是

A. 当外电路中有0.2mol e-转移时,A极区增加的H+的个数为0.2 NA
B. A极的电极反应式为![]() +2e-+H+
+2e-+H+![]() Cl-+
Cl-+![]()
C. 乙装置中铁电极应与甲装置中X相连接
D. 电镀过程中乙装置中CuSO4溶液浓度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的铁片和浓硫酸混合加热,充分应后得到溶液X,X中除Fe3+外还可能含有Fe2+.若要确认其中的Fe2+,应选用
A. KSCN溶液和氯水
B. 铁粉和KSCN溶液
C. 浓氨水
D. 酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将两烧杯中电极用导线相连,四个电极分别为Mg、Al、Pt、C。当闭合开关S后,以下表述正确的是( )
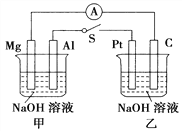
A. 电流表指针不发生偏转
B. Al、Pt两极有H2产生
C. 甲池pH减小,乙池pH不变
D. Mg、C两极生成的气体在一定条件下可以恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1L 0.l mol/L-1 CH3 COOH溶液中加入0.1molCH3COONa固体,溶液中
[c(CH3COO-)·c(H+)]/c(CH3COOH) (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 。
(2)土壤的pH一般在4-9之间。土壤中Na2CO3含量较高,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 ,加入石膏(CaSO4 2H2O)可以使土壤碱性降低,有关反应的化学方程式为
(3)常温下在20ml 0.1mo l·L-1 Na2CO3溶液中逐滴加入0.1mol·L-1 HC1溶液40mL,溶液中含碳元素的各种微粒(CO2)因逸出未画出)物质的量分数随溶液pH变化的情况如图所示。
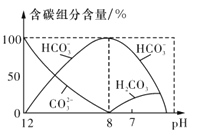
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32- (填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒为 ,溶液中各种离子的物质的量浓度的大小关系
为 ;
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=2×10-4mol·L-1,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH= ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答以下问题:
(1)常温下0.01mol/L HCl溶液由水电离产生的c(H+)与PH=11的CH3COONa溶液中由水电离产生的c(OH-)之比为________。
(2)实验室中配制AgNO3溶液时通常需要向其中加入硝酸目的是______________________;AgCl在水中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq)。25℃时,现将足量AgCl分别放入:①100mL蒸馏水;②100mL 0.2molL-1AgNO3溶液;③100mL 0.1molL-1氯化镁溶液;④100mL 0.1molL-1氯化钠溶液.充分搅拌后,相同温度下Ag+浓度由大到小的顺序是___________________ (填写序号)。
Ag+(aq)+Cl-(aq)。25℃时,现将足量AgCl分别放入:①100mL蒸馏水;②100mL 0.2molL-1AgNO3溶液;③100mL 0.1molL-1氯化镁溶液;④100mL 0.1molL-1氯化钠溶液.充分搅拌后,相同温度下Ag+浓度由大到小的顺序是___________________ (填写序号)。
(3)若浓度均为0.1mol·L-1、等体积的NaOH和NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则m_______n (填“>”“<”或“=”)。
物质的量浓度相同的①NH4Cl,②CH3COONH4,③NH4HSO4,④NH3·H2O四种稀溶液中,NH4+浓度由大到小的顺序是(填序号)_______
25℃时,将0.2mol/L CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合,测得混合溶液PH<7,写出溶液中所有离子浓度的大小顺序__________________________________,此时混合溶液___________(填“促进”或“抑制”)水的电离,溶液中c(CH3COOH)+c(CH3COO—)_______0.1mol/L(填“>”“<”或“=”);若保持温度不变,向体积相同、PH=2的盐酸和醋酸溶液分别加等浓度的氢氧化钠溶液至PH=7,盐酸所需氢氧化钠溶液的体积______醋酸所需氢氧化钠溶液的体积(填“>”“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com