
【题目】下列固体物质属于晶体的是
A. 橡胶B. 食盐C. 石蜡D. 玻璃
科目:高中化学 来源: 题型:
【题目】研究发现钼酸钠可减缓金属的腐蚀速率。工业上利用钼精矿(主要成分是不溶于水的MoS2,含少量重金属化合物)制备钼酸钠晶体( Na2MoO4·2H2O)的途径如图所示:

回答下列问题:
Ⅰ.(1)下列标志中,应贴在保存NaClO容器上的是 ___________。

(2)为了提高焙烧效率,除增大空气量外还可以采用的措施有_____________________。
(3)途径①制备钼酸钠溶液,同时有SO42-生成,该反应的离子方程式为_____________。
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是_________________________。
(5)“结晶”前测得部分离子浓度c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L,需加入Ba(OH)2固体除去SO42-。当BaMoO4开始沉淀时,SO42-的去除率为______%。(保留三位有效数字)[已知:Ksp(BaSO4)=1.1×10-10、Ksp(BaMoO4)=4.0×10-8,加入Ba(OH)2固体引起溶液体积变化可忽略]。

Ⅱ.(1)碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是_____。
(2)若缓释剂钼酸钠-月桂酰肌氨酸总浓度为300mgL-1,则缓蚀效果最好时钼酸钠的物质的量浓度为_________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示的有机物X可生产S-诱抗素Y。下列说法正确的是

A. 1 mol Y最多能和6 molH2发生加成反应
B. X可以发生氧化、取代、加聚、酯化等反应
C. Y可以与FeCl3溶液发生显色反应,又可使酸性高锰酸钾溶液退色
D. X结构中有2个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 二氧化硅是酸性氧化物,它可以跟碱反应,不能和任何酸反应
B. 光导纤维的主要成分是晶体硅
C. 硅石、石英、水晶、玛瑙中都含有二氧化硅
D. 明矾净水是因为其具有杀菌消毒的性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镁可用于牙膏、医药和化妆品等工业,化学式为4MgCO3·Mg(OH)2·5H2O,某碱式碳酸镁中含有SiO2杂质,为测定其纯度,某兴趣小组设计了如下几个方案:
方案I取一定质量的样品,与硫酸充分反应,通过测定生成CO2的质量计算纯度

(1)乙中发生反应的方程式为____________。
(2)仪器接口的连接顺序为(装置可以重复使用)a___________,丁的作用是__________。
(3)当样品充分反应完后,缓慢通入空气的目的是:____________。
方案Ⅱ①称取碱式碳酸镁样品mg;②将样品充分高温煅烧,冷却后称量;③重复操作②,测得剩余固体质量为m1g/。
(4)下列仪器中,该方案不会用到的是____________。

(5)判断样品完全分解的方法是_______;本实验至少需要称量_______次。
(6)有同学认为方案Ⅱ高温煅烧的过程中会发生MgCO3 +SiO2![]() MgSiO3 +CO2↑,会导致测定结果有误,你认为这位同学的观点正确吗?______。(填“正确”或“错误”)请说明理由:____________。
MgSiO3 +CO2↑,会导致测定结果有误,你认为这位同学的观点正确吗?______。(填“正确”或“错误”)请说明理由:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由Zn、Fe、Al、Mg四种金属中的两种组成的混合物6g,与足量的盐酸反应产生的氢气在标况下为2.24升,则混合物中一定含有的金属是
A. Zn B. Fe C. Al D. Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为1.0 mol·L-1的NH3·H2O和NH4Cl混合溶液10 mL,测得其pH为9.3。下列有关叙述正确的是( )
A. 加入适量的NaCl,可使c(NH![]() )=c(Cl-)
)=c(Cl-)
B. 滴加几滴浓氨水,c(NH![]() )减小
)减小
C. 滴加几滴浓盐酸,![]() 的值减小
的值减小
D. 1.0 mol·L-1的NH4Cl溶液中c(NH![]() )比该混合溶液中的大
)比该混合溶液中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1L 0.l mol/L-1 CH3 COOH溶液中加入0.1molCH3COONa固体,溶液中
[c(CH3COO-)·c(H+)]/c(CH3COOH) (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 。
(2)土壤的pH一般在4-9之间。土壤中Na2CO3含量较高,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 ,加入石膏(CaSO4 2H2O)可以使土壤碱性降低,有关反应的化学方程式为
(3)常温下在20ml 0.1mo l·L-1 Na2CO3溶液中逐滴加入0.1mol·L-1 HC1溶液40mL,溶液中含碳元素的各种微粒(CO2)因逸出未画出)物质的量分数随溶液pH变化的情况如图所示。
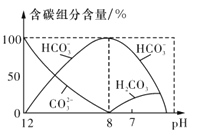
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32- (填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒为 ,溶液中各种离子的物质的量浓度的大小关系
为 ;
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=2×10-4mol·L-1,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH= ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com