
【题目】利用下图所示的有机物X可生产S-诱抗素Y。下列说法正确的是

A. 1 mol Y最多能和6 molH2发生加成反应
B. X可以发生氧化、取代、加聚、酯化等反应
C. Y可以与FeCl3溶液发生显色反应,又可使酸性高锰酸钾溶液退色
D. X结构中有2个手性碳原子
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】利用芳香烃X和链烃Y可以合成紫外线吸收剂BAD, BAD的结构简式为:

BAD的合成路线如下(己知G不能发生银镜反应,B遇FeCl3溶液显紫色,C到D的过程是引入羧基的反应):
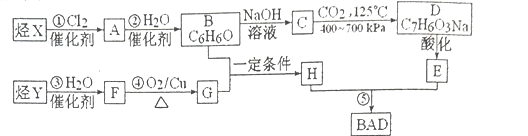
试回答下列问题:
(1)写出Y的结构简式________________;E的含氧官能团名称_______________。
(2)属于加成反应的有__________________(填数字序号)。
(3)1 mol BAD最多可与含________________mol NaOH的溶液完全反应。
(4)写出下列反应的化学方程式:
反应④:______________________________;
F+E→:______________________________;
(5)E有多种同分异构体,写出所有符合下列条件的同分异构体的结构简式 _________________。
A.能发生银镜反应 B.遇FeCl3溶液显紫色 C.核磁共振氢谱图中有4个吸收峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在10 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是

A. 在0.1 mol·L-1Na2CO3溶液中:c(Na+)+c(H+)=c(CO![]() )+c(HCO
)+c(HCO![]() )+c(OH-)
)+c(OH-)
B. 当溶液的pH为7时,溶液的总体积为20 mL
C. 在B点所示的溶液中,离子浓度最大的是HCO![]()
D. 在A点所示的溶液中:c(CO![]() )=c(HCO
)=c(HCO![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
H、C、N、O、Na、Fe、Cu是常见的七种元素,请回答下列问题:
(1)N、O、Na原子第一电离能由小到大的顺序是 (用元素符号和“<”表示);Cu原子的特征电子轨道式为 。
(2)N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数最多的是_____;Cu2+在水中呈现蓝色是因为形成了水合铜离子,其化学式为 ,水分子与铜离子间结合的化学键名称为 。
(3)根据价层电子对互斥理论判断下列分子或离子中空间构型是V形的是_____(填序号):①H3O+、②H2O、 ③NO2+ 、④NO2- 。
(4)分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为 ,1个分子中含有____个![]() 键;(CN)2称为“拟卤素”,具有类似Cl2的化学性质,则(CN)2与NaOH水溶液反应的化学方程式为 。
键;(CN)2称为“拟卤素”,具有类似Cl2的化学性质,则(CN)2与NaOH水溶液反应的化学方程式为 。
(5)O和Na形成的一种只含有离子键的离子化合物,其晶胞结构如图,该离子化合物的化学式为___________;已知该晶胞的密度为![]() ,阿伏加德罗常数为NA,求晶胞边长a=________cm。(用含
,阿伏加德罗常数为NA,求晶胞边长a=________cm。(用含![]() 、NA的代数式表示)。
、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组探究在加热条件下FeSO4分解的气体产物及相关性质。已知:SO2的沸点为-10℃、SO3的沸点为44.8℃。
Ⅰ.用如图所示装置设计实验,验证分解FeSO4生成的气态产物。

(1)实验前必须进行的操作是_______________________。
(2)按气流方向连接各仪器,用字母表示接口的连接顺序:a→_________________。
(3)若观察到装置丙中有无色液体产生,装置丁中溶液变成无色,则 FeSO4分解的化学方程式为____________________。
Ⅱ.为探究SO2使品红溶液褪色的原理,进行如下实验:
实验1:将稀盐酸和NaOH溶液分别滴入品红水溶液中。观察到前者溶液颜色变浅,但未能完全褪色,后者溶液颜色几乎不变。
实验2:在滴有稀盐酸和NaOH溶液的两份品红水溶液中分别通入SO2。观察到前者溶液逐渐褪色,后者溶液很快褪色。
实验3:在两份品红水溶液中分别加入一小粒Na2SO3固体和NaHSO3固体,前者溶液很快褪色,后者溶液褪色很慢。
(1)由实验1可推测品红水溶液呈________性。
(2)由实验2、3可推知,使品红水溶液褪色的主要微粒是_________(填化学式)。
(3)若将SO2通入品红的无水乙醇溶液,试预测可能出现的现象________________。
(4)加热溶有Na2SO3的品红水溶液,发现不能恢复红色,试解释原因____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
(1)该蓄电池充电时,发生还原反应的物质是 (填下列字母),放电时生成Fe(OH)2的质量18 g,则外电路中转移的电子数是 。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常把船体与浸在海水里的Zn块相连,或与该蓄电池这样的直流电源的 极(填“正”或“负”)相连。
(3)以该蓄电池做电源,用右图所示装置,在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示)。 。

(4)精炼铜时,粗铜应与直流电源的 极(填“正”或“负”)相连,精炼过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解,甲同学设计如下除杂方案:
![]()
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀时的pH | 2.3 | 7.5 | 5.6 | 6.2 |
完全沉淀时的pH | 3.9 | 9.7 | 6.4 | 8.0 |
则加入H2O2的目的是 ,乙同学认为应将方案中的pH调节到8,你认为此观点 (填“正确”或“不正确”),理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com