
【题目】有五种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
E | 基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |
请根据表中信息填写:
⑴A元素在元素周期表中的位置____________________________________________。
⑵离子半径:B_________A(填“大于”或“小于”)。
⑶C原子的电子排布图是______________,其原子核外有________个未成对电子,能量最高的电子为________轨道上的电子,其轨道呈________形。
⑷B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的离子方程式为_____________,与D最高价氧化物的水化物水溶液反应的化学方程式为___________。
⑸E元素基态原子的电子排布式为____________________.
【答案】 第三周期第ⅠA族 小于 ![]() 3 2p 哑铃 OH-+Al(OH)3=== AlO2-+2H2O 3HClO4+Al(OH)3===Al(ClO4)3+3H2O 1s22s22p63s23p63d104s1或[Ar]3d104s1
3 2p 哑铃 OH-+Al(OH)3=== AlO2-+2H2O 3HClO4+Al(OH)3===Al(ClO4)3+3H2O 1s22s22p63s23p63d104s1或[Ar]3d104s1
【解析】(1)Na元素在元素周期表中的位置是第三周期第ⅠA族。(2)离子的核外电子排布相同时,离子半径随原子序数的增大而减小,则离子半径:B小于A。(3)N原子的电子排布图是![]() ,其原子核外有3个未成对电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形。(4)B的最高价氧化物对应的水化物氢氧化铝与A的最高价氧化物对应的水化物氢氧化钠反应的离子方程式为OH-+Al(OH)3=AlO2-+2H2O ;与D最高价氧化物的水化物水溶液高氯酸反应的化学方程式为3HClO4+Al(OH)3=Al(ClO4)3+3H2O。(5)Cu元素基态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1。
,其原子核外有3个未成对电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形。(4)B的最高价氧化物对应的水化物氢氧化铝与A的最高价氧化物对应的水化物氢氧化钠反应的离子方程式为OH-+Al(OH)3=AlO2-+2H2O ;与D最高价氧化物的水化物水溶液高氯酸反应的化学方程式为3HClO4+Al(OH)3=Al(ClO4)3+3H2O。(5)Cu元素基态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】由Zn、Fe、Al、Mg四种金属中的两种组成的混合物6g,与足量的盐酸反应产生的氢气在标况下为2.24升,则混合物中一定含有的金属是
A. Zn B. Fe C. Al D. Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将两烧杯中电极用导线相连,四个电极分别为Mg、Al、Pt、C。当闭合开关S后,以下表述正确的是( )
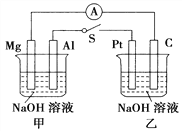
A. 电流表指针不发生偏转
B. Al、Pt两极有H2产生
C. 甲池pH减小,乙池pH不变
D. Mg、C两极生成的气体在一定条件下可以恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1L 0.l mol/L-1 CH3 COOH溶液中加入0.1molCH3COONa固体,溶液中
[c(CH3COO-)·c(H+)]/c(CH3COOH) (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 。
(2)土壤的pH一般在4-9之间。土壤中Na2CO3含量较高,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 ,加入石膏(CaSO4 2H2O)可以使土壤碱性降低,有关反应的化学方程式为
(3)常温下在20ml 0.1mo l·L-1 Na2CO3溶液中逐滴加入0.1mol·L-1 HC1溶液40mL,溶液中含碳元素的各种微粒(CO2)因逸出未画出)物质的量分数随溶液pH变化的情况如图所示。
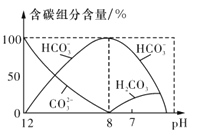
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32- (填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒为 ,溶液中各种离子的物质的量浓度的大小关系
为 ;
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=2×10-4mol·L-1,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH= ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能用勒夏特列原理解释的是
A. 使用铁触媒,加快合成氨反应速率 B. 实验室用排饱和食盐水法收集氯气
C. 打开汽水瓶盖,即有大量氕泡逸出 D. 温度升高,纯水中的H+浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍氢电池已经成为混合动力汽车的主要电池类型。该电池放电时的总反应为:NiOOH + MH==Ni(OH)2 + M,其中M表示储氢合金,MH表示吸附了氢原子的储氢合金,下列说法正确的是
A. 放电时负极反应为:MH+OH--e-==M+H2O
B. 放电时,每转移1mol电子,有1mol NiOOH被氧化
C. 充电时正极反应为:NiOOH+H2O+e-==Ni(OH)2+OH-
D. 电池电解液可用KOH溶液,充电过程中KOH浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋(Bi)的无毒与不致癌性有很多特殊用途,其化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为Bi2S3,含杂质PbO2等)制备Bi2O3的工艺如下:

回答下列问题:
(1)Bi位于元素周期表第六周期,与N、P同族,Bi的原子结构示意图为________。
(2)“浸出”时Bi2S3与FeCl3溶液反应的化学方程式为________,反应液必须保持强酸性,否则铋元素会以BiOCl(碱式氯化铋)形式混入浸出渣使产率降低,原因是________(用离子方程式表示)。

(3)“置换”时生成单质铋的离子方程式为________。“母液1”中通入气体X后可循环利用,气体X的化学式为________。
(4)“粗铋”中含有的杂质主要是Pb,通过熔盐电解精炼可达到除杂的目的,其装置示意图如右。电解后,阳极底部留下的为精铋。写出电极反应式:阳极________;阴极________。
(5)碱式硝酸铋直接灼烧也能得到Bi2O3,上述工艺中转化为碱式碳酸铋再灼烧,除了能改良产品性状,另一优点是________。“母液2”中可回收的主要物质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答以下问题:
(1)常温下0.01mol/L HCl溶液由水电离产生的c(H+)与PH=11的CH3COONa溶液中由水电离产生的c(OH-)之比为________。
(2)实验室中配制AgNO3溶液时通常需要向其中加入硝酸目的是______________________;AgCl在水中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq)。25℃时,现将足量AgCl分别放入:①100mL蒸馏水;②100mL 0.2molL-1AgNO3溶液;③100mL 0.1molL-1氯化镁溶液;④100mL 0.1molL-1氯化钠溶液.充分搅拌后,相同温度下Ag+浓度由大到小的顺序是___________________ (填写序号)。
Ag+(aq)+Cl-(aq)。25℃时,现将足量AgCl分别放入:①100mL蒸馏水;②100mL 0.2molL-1AgNO3溶液;③100mL 0.1molL-1氯化镁溶液;④100mL 0.1molL-1氯化钠溶液.充分搅拌后,相同温度下Ag+浓度由大到小的顺序是___________________ (填写序号)。
(3)若浓度均为0.1mol·L-1、等体积的NaOH和NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则m_______n (填“>”“<”或“=”)。
物质的量浓度相同的①NH4Cl,②CH3COONH4,③NH4HSO4,④NH3·H2O四种稀溶液中,NH4+浓度由大到小的顺序是(填序号)_______
25℃时,将0.2mol/L CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合,测得混合溶液PH<7,写出溶液中所有离子浓度的大小顺序__________________________________,此时混合溶液___________(填“促进”或“抑制”)水的电离,溶液中c(CH3COOH)+c(CH3COO—)_______0.1mol/L(填“>”“<”或“=”);若保持温度不变,向体积相同、PH=2的盐酸和醋酸溶液分别加等浓度的氢氧化钠溶液至PH=7,盐酸所需氢氧化钠溶液的体积______醋酸所需氢氧化钠溶液的体积(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H—H键键能为436 kJ/mol,H-N键键能为391 kJ/mol。根据热化学方程式3H2(g)+N2(g)= 2NH3(g) △H=-92.4kJ/mol,则N≡N键的键能是 ( )
A. 431.4 kJ/mol B. 945.6 kJ/mol
C. 649.6 kJ/mol D. 896.6 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com