
| A.Na2CO3、BaCl2 | B.BaCl2、Na2CO3、H2SO4 |
| C.BaCl2、Na2CO3、HCl | D.Ba(NO3)2、Na2CO3、HCl |
科目:高中化学 来源:不详 题型:实验题

| A.50mL烧杯 | B.50mL量筒 | C.25mL碱式滴定管 | D.25mL酸式滴定管 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 |
| A | 中和反应 | —— | 溶 解 | 产生氢气 |
| B | —— | 有银镜 | 加热后有红色沉淀 | 产生氢气 |
| C | 水解反应 | 有银镜 | 加热后有红色沉淀 | —— |
| D | 水解反应 | —— | —— | —— |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硝基苯、苯、乙醇三种液体 |
B.硫酸 钠、硝酸钾、氯化钡三种固体 钠、硝酸钾、氯化钡三种固体 |
| C.硫磺、过氧化钠、氯化钙三种固体 |
| D.氯化铝、偏铝酸钠、烧碱三种固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.皮肤上沾有少量苯酚,立即用大量浓氢氧化钠溶液洗去 |
| B.欲提纯鸡蛋白溶液中的蛋白质,用饱和的醋酸铅溶液进行盐析 |
| C.金属钠非常活泼,应将其保存在汽油中,以隔绝空气和水 |
D.仅 用溴水可鉴别苯、四氯化碳、2-戊烯、乙醇四种无色液体 用溴水可鉴别苯、四氯化碳、2-戊烯、乙醇四种无色液体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 。
。 _____。
_____。| A.该学生在量取浓硫酸时,俯视刻度线 |
| B.称量固体NaOH时,将砝码和物品的位置颠倒(没有使用游码) |
C.溶解H2SO4操作时没有冷却至室温就立即完成后面的配制操 作。 作。 |
D.在烧杯中溶解 搅拌时,溅出少量溶液 搅拌时,溅出少量溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拦一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
| B | 向某溶液中加入BaCl2溶液生成白色沉淀,继续加稀硝酸沉淀不消失 | 证明溶液中含SO42- |
| C | 向某溶液中加入稀盐酸,放出无色无味气体,将气体通入澄清石灰水,石灰水变浑浊 | 证明该溶液中存在CO32- |
| D | 向0.1mol·L-1FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色 | 证明Fe2+具有氧化性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
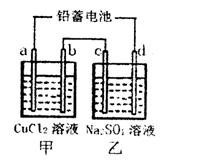
 2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是______
2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是______ ______
______| A.d极为阴极 |
| B.若利用甲池精炼铜,b极应为粗铜 |
| C.放电时铅蓄电池负极的电极反应式为: PbO2(s)+4H+(aq)+ 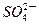 (aq)+4e- (aq)+4e- PbSO4(s)+2H2O(1) PbSO4(s)+2H2O(1) |
| D.若四个电极材料均为石墨,当析出6.4g Cu时,两池中共产生气体3.36L(标准 |
 H++A2-,请回答下列问题:
H++A2-,请回答下列问题: mol·L-1的NaHA溶液的pH=2,则0.1mol·L-1的H2A溶液中氢离子的物质的量浓度可能是__________0.1lmol·L-1(填“<”、“>”或“=”),理由是:___________________________.
mol·L-1的NaHA溶液的pH=2,则0.1mol·L-1的H2A溶液中氢离子的物质的量浓度可能是__________0.1lmol·L-1(填“<”、“>”或“=”),理由是:___________________________. CH3OH(g); △H=-90.8kJ·mol-1
CH3OH(g); △H=-90.8kJ·mol-1 CH3OH(g)
CH3OH(g) CH3OCH3(g)+H2O(g); △H=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g); △H=-23.5kJ·mol-1 CO2(g)+H2(g);△=-41.3kJ·mol-1
CO2(g)+H2(g);△=-41.3kJ·mol-1 2SO3(g)。在一定温度下,将0.23 mol SO2和0.11 mol氧气放入容积为l L的密闭容器中发生反应,达到平衡后得到0.12 mol SO3,则反应的平衡常数K=________。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO3的体积分数将___________(填“增大”、“不变”或“减小”)。
2SO3(g)。在一定温度下,将0.23 mol SO2和0.11 mol氧气放入容积为l L的密闭容器中发生反应,达到平衡后得到0.12 mol SO3,则反应的平衡常数K=________。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO3的体积分数将___________(填“增大”、“不变”或“减小”)。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com