
【题目】N2H4是一种高效清洁的火箭燃料,0.25mol N2H4 (g)完全燃烧生成氮气和气态水时,放出133.5kJ热量.则下列热化学方程式中正确的是( )
A. ![]() N2H4 (g) +
N2H4 (g) +![]() O2(g) =
O2(g) =![]() N2(g)+H2O (g) △H=+267kJ/mol
N2(g)+H2O (g) △H=+267kJ/mol
B. N2H4 (g) + O2(g) =N2(g)+2H2O (g) △H=-534kJ/mol
C. N2H4 (g) + O2(g) =N2(g)+2H2O (g) △H=+534kJ/mol
D. N2H4 (g) + O2(g) =N2(g)+2H2O (l) △H=-133.5kJ/mol
【答案】B
【解析】A、0.25molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量,其焓变是负值,故A、C错误;B、0.25molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量,则1molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ×4=534kJ的热量,热化学方程式为:N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJmol-1,故B正确;D、0.25molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量,则1molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ×4=534kJ的热量,则生成液态水,放出的热量大于534kJ,故D错误;故选B。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,将224 L HC1气体溶于635 mL水中,所得盐酸的密度为1.18g·cm-3。试计算:
①取出这种盐酸100 mL,稀释至1.18 L,所得稀盐酸的物质的量浓度是________。
②在40.0 mL 0.065 mol·L-1 Na2CO3溶液中,逐渐加入(2)所稀释的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过________mL。
(2)配制0.80 mol·L-1 NaOH溶液475 mL,回答下列问题:
①根据计算用托盘天平称取NaOH的质量为____g。在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度____0.80 mol·L-1(填“大于”、“等于”或“小于”,下同)。若还未等溶液冷却就定容了,则所得溶液浓度_____0.80 mol·L-1 。
②0.80 mol·L-1 NaOH溶液质量分数和等质量的水混合溶液浓度 _____0.40 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若某原电池的离子方程式是Zn+Cu2+=Zn2++Cu,则该原电池的构成是( )
正极 | 负极 | 电解质溶液 | |
A | Cu | Zn | HCl |
B | Zn | Cu | CuSO4 |
C | Cu | Zn | CuSO4 |
D | Cu | Zn | ZnCl2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图两圆相交部分A、B、C、D分别表示两物质间的反应。下列各对应反应的离子方程式书写不正确的是

A.Fe+4H++NO![]() ===Fe3++NO↑+2H2O
===Fe3++NO↑+2H2O
B.Fe3O4+8H+===Fe2++2Fe3++4H2O
C.Fe(OH)3+3H+===Fe3++3H2O
D.3Fe(OH)2+10H++NO![]() ===3Fe3++NO↑+8H2O
===3Fe3++NO↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为直流电源电解稀Na2SO4水溶液的装置,通电后在石墨电极a和b附近分别滴加石蕊溶液,下列实验现象正确的是( )

A. 逸出气体的体积:a电极的小于b电极的
B. a电极附近呈蓝色,b电极附近呈红色
C. a电极附近呈红色,b电极附近呈蓝色
D. 一电极逸出无味气体,另一电极逸出刺激性气味气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.CH3COOCH2CH3和CH3CH2OOCCH3互为同分异构体 B.红磷和白磷互为同素异形体
C.37Cl和35Cl 互为同位素D.CH3CH2CH(CH3)2的名称为2-甲基丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3的混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是

A. a点对应的溶液中:Na+、OH-、SO42-、NO3-
B. c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
C. b点对应的溶液中:Al3+、Fe3+,MnO4-、Cl-
D. d点对应的溶液中:F-、NO3-、Fe2+、Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知R2-核外有10个电子,则关于R元素叙述正确的是( )
A. R元素的原子序数是10 B. R2-是O2-
C. R元素最高正化合价为+6 D. R元素位于第二周期第ⅡA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在密闭容器中充入1molH2和1molI2,压强为P(Pa),并在—定温度下使其发生反应:H2(g)+I2(g) ![]() 2HI(g) △H<0。保持容器内气体压强不变,向其中加入1molN2,反应速率______(填“变大”、“ 变小”或“不变”),平衡_________ 移动(填“向正反应方向”、“ 向逆反应方向”或“不”)。
2HI(g) △H<0。保持容器内气体压强不变,向其中加入1molN2,反应速率______(填“变大”、“ 变小”或“不变”),平衡_________ 移动(填“向正反应方向”、“ 向逆反应方向”或“不”)。
(2)火箭残骸中存在红棕色气体,原因为:N2O4![]() 2NO2(g) △H
2NO2(g) △H
①当温度升高时,气体颜色变深,则反应为_______________( “吸热”或“放热”)反应。
②T℃,将1molN2O4充入恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态是____________
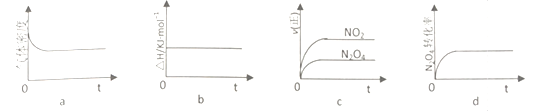
③T℃,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数___________(填“增大”“ 不变”或“减小”)。
(3)已知 4HCl(g)+O2(g) ![]() 2Cl2 (g)+2H2O(g)中 2mol HCl被氧化,放出 57.8kJ 的热量,且部分化学键断裂示意图如下:
2Cl2 (g)+2H2O(g)中 2mol HCl被氧化,放出 57.8kJ 的热量,且部分化学键断裂示意图如下:
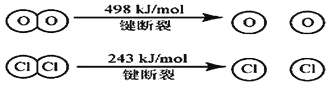
①写出该反应的热化学方程式___________________ 。
②断开1 mol H-O键与断开1 molH-C1键所需能量相差约为_________kJ,H2O中H-O键比HCl中H-Cl键___________(填“强”或“弱”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com