
向一密闭容器中充入1mol A,2mol B,发生如下反应:A(g)+2B(g)![]() C(s)+3D(g), 在一定条件下达到平衡,测得混合气体D的浓度为l.4mol/L;
C(s)+3D(g), 在一定条件下达到平衡,测得混合气体D的浓度为l.4mol/L;
⑴若压缩容器增大压强,则逆反应的速率 ;容器中D的浓度 ;(填“增大”、“减小”或“不变”)
⑵温度升高,混合气体平均相对分子质量增大,则正反应 ;(填“吸热”或“放热”)
⑶在一体积可变的密闭容器中,充入0.8mol C,3.5mol D,若使D的浓度仍为l.4mol/L,则容器体积取值范围为 。
![]()
![]()
![]()
此题考查了化学反应速率与限度的知识,平衡移动与外界条件的关系符合勒夏特列原理,即改变影响化学平衡的一个条件,平衡向减弱这种改变的方向移动。但是平衡的移动只能减弱这种改变,不能把这种改变完全抵消。压缩容器增大压强,正逆反应的速率都增加,结合反应方程式可知,反应前后气体体积相等,压强改变对正逆反应速率的产生的影响相同,即正逆反应速率增大的幅度相同,所以平衡不移动,容器压缩后体积减小,D的物质的量不变,则D的浓度增大。结合题意:C是固态,反应前后的气体体积不变,混合气体平均相对分子质量增大说明平衡向逆反应方向移动,因为温度升高平衡向吸热反应的方向移动,即逆反应吸热,正反应放热。由问题⑶可知,该条件下达到的平衡与题干表述的条件下达到的平衡是等效平衡,等效平衡是指条件不变时,只要加入的的各物质成一定的比例,可逆反应不论采取何种途径即由正反应开始或由逆反应开始,最后所处的平衡状态时相同的。,因为问题⑶中反应容器体积可变,即压强一定,并且此反应前后气体体积不变,所以当从只有D是气体的逆反应方向开始反应,无论加入任何量的D气体,达到的平衡状态与题干条件下达到的平衡都是等效平衡。即无论容器体积的大小如何变化D的浓度都为1.4mol/L,但是,D的多少会受到物质C的量的限制,可逆反应中C会参加反应,但不能完全反应。因此,可以采用极限法来讨论:
假设C完全反应,此时,容器中D的物质的量为3.5mol-2.4mol=1.1mol,
1.4mol/L=![]() ,V=
,V=![]()
![]() L
L
假设C完全不反应,此时容器中D的物质的量是3.5mol ,同法可求出V=2.5L
即容器体积的取值范围是2.5L﹥V﹥![]() L。
L。


科目:高中化学 来源: 题型:
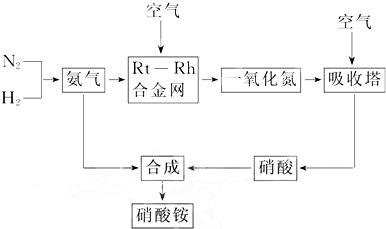
| c4(NO)?c6(H2O) |
| c4(NH3)?c5(O2) |
| c4(NO)?c6(H2O) |
| c4(NH3)?c5(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
![]()
现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生,下列有关说法正确的是( )
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应的速率都为零
查看答案和解析>>
科目:高中化学 来源: 题型:
哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生。下列有关说法正确的是
A. 达到化学平衡时,N2将完全转化为NH3
B. 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C. 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D. 达到化学平衡时,正反应和逆反应的速率都为零
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省慈溪市高三上学期期中考试化学试卷 题型:选择题
哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生,有关说法正确的是 ( )
A、达到化学平衡时,N2将完全转化为NH3
B、达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C、达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应的速率都为零
查看答案和解析>>
科目:高中化学 来源:2010年河北省高二9月月考化学试题 题型:选择题
哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生,有关说法正确的是
N2+3H2 2NH3
2NH3
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应的速率都为零
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com