
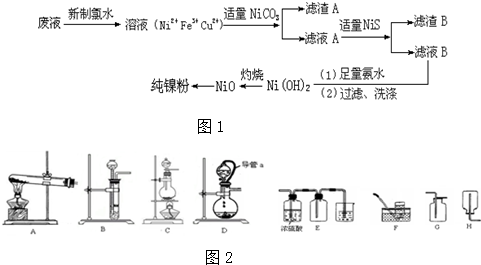
分析 电镀废液(含有NiSO4、CuSO4和FeSO4)加新制氯水,亚铁离子被氧化为Fe3+,加入NiCO3调节pH,使Fe3+转化为Fe(OH)3沉淀,过滤,滤渣A为 Fe(OH)3沉淀,滤液A中含有Ni2+和Cu2+,再加适量的NiS,Cu2+转化为CuS沉淀,过滤,滤渣B为CuS沉淀,滤液B为NiSO4,加足量的氨水,生成Ni(OH)2沉淀,过滤、洗涤得到Ni(OH)2,灼烧得到NiO,最后还原得到Ni;
(1)加新制氯水,亚铁离子被氧化为Fe3+;
(2)调节溶液pH使Fe3+转化为Fe(OH)3沉淀;
(3)根据灼烧的实验操作分析;
(4)通过金属之间的置换反应提取Ni,操作简便、节省原料、安全;用氢气还原不会引入杂质;
(5)制备氢气用稀硫酸与Zn反应,属于固液不需要加热的装置;收集氢气用向下排空气法或排水法;
(6)装置D中分液漏斗与烧瓶用胶管连接时压强相同.
解答 解:电镀废液(含有NiSO4、CuSO4和FeSO4)加新制氯水,亚铁离子被氧化为Fe3+,加入NiCO3调节pH,使Fe3+转化为Fe(OH)3沉淀,过滤,滤渣A为 Fe(OH)3沉淀,滤液A中含有Ni2+和Cu2+,再加适量的NiS,Cu2+转化为CuS沉淀,过滤,滤渣B为CuS沉淀,滤液B为NiSO4,加足量的氨水,生成Ni(OH)2沉淀,过滤、洗涤得到Ni(OH)2,灼烧得到NiO,最后还原得到Ni;
(1)电镀废液中含有Fe2+,加新制氯水,亚铁离子被氧化为Fe3+,其反应的离子方程式为:Cl2+2Fe2+═2Fe3++2Cl-;
故答案为:Cl2+2Fe2+═2Fe3++2Cl-;
(2)由流出分析可知Fe3+为杂质,所以加入NiCO3,调节溶液pH使Fe3+转化为Fe(OH)3沉淀而去除,由表格中数据可知pH=3.7时铁离子完全沉淀,
故答案为:调节溶液pH=3.7,使溶液中的 Fe3+完全变成Fe(OH)3沉淀而除去;
(3)灼烧时用到坩埚,加热仪器酒精灯,还有三脚架、泥三角和坩埚钳,
故答案为:酒精灯、三脚架、泥三角、坩埚、坩埚钳;
(4)方案1:氧化镍溶于稀硫酸,加入足量锌粉,过滤、洗涤、干燥,通过金属之间的置换反应提取Ni,操作简便、节省原料、安全,但是易引入杂质Zn;
方案2:锌与稀硫酸反应产生氢气,氢气还原氧化镍;用氢气还原不会引入杂质,所以得到的产品纯度较高,但是操作较复杂、会有空气是会发生爆炸;
故答案为:操作简便、节省原料、实验安全;产品纯度较高;
(5)制备氢气用稀硫酸与Zn反应,属于固液不需要加热的装置,所以可以选用BD;氢气的密度比空气小,收集氢气用向下排空气法,氢气难溶于水,可以用排水法收集,则选用FH;
故答案为:BD;FH;
(6)分液漏斗与烧瓶用胶管连接时压强相同,便于分液漏斗中液体顺利流下;
故答案为:平衡分液漏斗和烧瓶中的气压,便于分液漏斗中液体顺利流下.
点评 本题考查了物质分离的实验设计和物质制备方案设计,涉及氧化还原反应、利用溶液不同PH条件下离子沉淀的情况不同控制溶液PH除去杂质离子、气体的制备方法和仪器选择等,题目难度中等,注意除杂原则不能引入新的杂质.


 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol SiO2晶体中,含有2NA个Si-O共价键 | |
| B. | 常温下,4.4 g CO2和N2O混合物中所含有的原子数为0.3NA | |
| C. | 0.2 mol Cl2溶解于等体积的水中,转移电子数为0.2NA | |
| D. | 标准状况下,11.2L 四氯化碳所含分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40mL | B. | 72mL | C. | 80mL | D. | 128mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO | |
| B. | BeCl2溶液的pH<7,将其蒸干并灼烧后得到的残留物可能是BeO | |
| C. | Be(OH)2只能溶于盐酸,不能溶于NaOH溶液 | |
| D. | BeCl2水溶液的导电性强,故BeCl2是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .根据所学知识,可以判断( )
.根据所学知识,可以判断( )| A. | 聚苯乙烯能使溴水褪色 | |
| B. | 聚苯乙烯是一种天然高分子化合物 | |
| C. | 聚苯乙烯可由苯乙烯通过化合反应制得 | |
| D. | 聚苯乙烯单体的分子式为C8H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com