
| A. | 40mL | B. | 72mL | C. | 80mL | D. | 128mL |
分析 根据电荷守恒计算混合溶液中n(Al3+),向MgCl2和AlCl3的混合溶液加入NaOH溶液,使Mg2+全部转化为沉淀分离出来,Al3+应恰好转化为AlO2-,反应后溶液为NaCl、NaAlO2的混合液,根据钠离子守恒n(NaOH)=n(NaCl)+n(NaAlO2),再结合氯离子守恒、Al原子守恒可知n(NaOH)=c(Cl-)+n(Al3+),再根据V=$\frac{n}{c}$计算.
解答 解:溶液中n(Cl-)=0.2L×1.3mol/L=0.26mol,
溶液中n(Mg2+)=0.2mol/L×0.2L=0.04mol,
所以溶液中n(Al3+)=$\frac{0.26mol-0.04mol×2}{3}$=0.06mol,
将200mL此溶液中的Mg2+转化为Mg(OH)2沉淀并分离析出,反应后溶液为NaCl、NaAlO2的混合液,根据钠离子守恒n(NaOH)=n(NaCl)+n(NaAlO2),再结合氯离子守恒、Al原子守恒可知n(NaOH)=c(Cl-)+n(Al3+)=0.26mol+0.06mol=0.32mol,
所以至少需要4mol/L氢氧化钠溶液的体积为$\frac{0.32mol}{4mol/L}$=0.08L=80mL,
故选C.
点评 本题考查混合物的有关计算,利用原子守恒简化解题,关键在于清楚反应后溶液为NaCl、NaAlO2的混合液.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:多选题
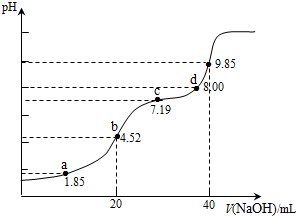
| A. | a点所得溶液中:2c(H2SO3)+c(SO32-)=0.1 mol•L-1 | |
| B. | b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | |
| C. | c点所得溶液中:c(Na+)<3c($HS{{{O}_{3}}^{-}}_{\;}$) | |
| D. | d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液 蒸馏 萃取 | B. | 萃取 蒸馏 分液 | C. | 分液 萃取 蒸馏 | D. | 蒸馏 萃取 分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应 Fe+2H+═Fe3++H2↑ | |
| B. | 氯化铝溶液与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| C. | 碳酸钙与稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 氢氧化铝与足量盐酸反应 Al(OH)3+3H+═Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直接露天焚烧秸秆 | B. | ?风能发电 | ||
| C. | 汽车直接排放尾气 | D. | 用石油作燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
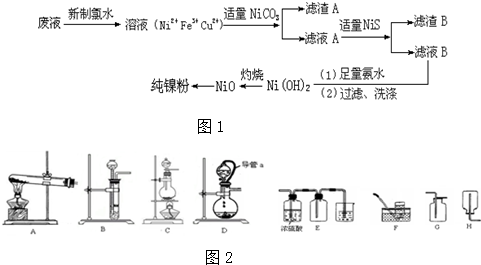
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 14g乙烯和丙烯的混合物中,含有共用电子对数目为3NA | |
| B. | 1mol苯酚中“C=C”的个数为3NA | |
| C. | 标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为$\frac{5}{22.4}$NA | |
| D. | 标准状况下,560mL甲烷和甲醛的混合气体中,含有的共用电子对数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ | ⑨ |
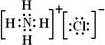 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com