
����Ŀ����֪���ᡢ��ˮ���ܶ�������ˮ�����Ĺ�ϵ��ͼ��ʾ�����������백ˮ��һ�ݣ�����ݱ�����Ϣ���ش��������⣺

���ʵ����ʵ���Ũ��/mol��L-1 | ��Һ���ܶ�/g��cm-3 | |
���� | c1 | ��1 |
��ˮ | c2 | ��2 |
��1�������������������Ϊ__________����д��λ���ú�c1����1�Ĵ���ʽ��ʾ����
��2�����ʵ���Ũ��Ϊc1mol��L-1��������ˮ�������ϣ���Ϻ���Һ������仯���Բ��ƣ���������Һ�����ʵ���Ũ��Ϊ__________mol��L-1��
��3�������ʵ���Ũ�ȷֱ�Ϊc2mol��L-1��1/5c2mol��L-1�İ�ˮ��������ϣ�������Һ���ܶ�__________����������������С������������������ͬ�� ��2 g��cm-3��������Һ�����ʵ���Ũ��__________ 3/5c2mol��L-1�����Ϻ���Һ������仯���Բ��ƣ���
���𰸡���1��98c1/1000��1����2��0.5c1 ����3�����ڣ����ڡ�
��������
�����������1������c=1000��w%/M��������ֵ���������������98c1/1000��1����2�����������ΪVL����Ϻ���Һ������仯���Բ��ƣ�����ܻ�Ϻ���Һ�����Ϊ2V��ϡ��ǰ���������ʵ������䣬�������ʵ���Ũ�ȵĶ��壬Vc1/2Vmol��L��1=0.5c1mol��L��1����3�������ܶȺͼ�ˮ�����仯���ߣ����ְ�ˮ����൱�ڶ�c2��ˮ����ϡ�ͣ���˻�Ϻ���Һ���ܶȴ�����2����c2mol��L��1��0.5c2mol��L��1�İ�ˮ������ֱ���aL��bL����Ϻ�����仯���Բ��ƣ���˻�Ϻ���Һ�����Ϊ(a��b)L����Ϻ���������ʵ���Ũ��Ϊ(ac2��b��0.5c2)/(a��b)=c2��0.8c2/(1��a/b)mol��L��1����ˮ���ܶ����������������������С��������=m/V��a>b��0.8c2/(1��a/b)<0.4c2����˻�Ϻ���Һ�����ʵ���Ũ�ȴ���0.6c2��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����������Ļ�ѧԪ�ص���������ȷ����
A. ��ͬ�������ڵĸ��ֻ�ѧԪ�صĺ�������������ͬ
B. ���������Ļ�ѧԪ������Ȼ�綼�����ҵ�
C. �ˡ�������ֲ�������Ļ�ѧԪ�ص��������ϴ�
D. �����������������Ȼ��Ļ�ѧԪ���У�̼Ԫ�صĺ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������״����飩�й����ʵ���Ũ�ȵļ���
��1����4gNaOH��������ˮ���250mL��Һ������Һ��NaOH�����ʵ���Ũ��Ϊ_________mol/L��ȡ��10mL����Һ�����к���NaOH_________g����ȡ������Һ��ˮϡ�͵�100mL��ϡ�ͺ���Һ��NaOH�����ʵ���Ũ��Ϊ_________mol/L��

��2����ͼʵ����ijŨ�����Լ�ƿ��ǩ�ϵ��й����ݣ��ݴ˼��㣺��Ũ������HCl�����ʵ���Ũ��Ϊ__________mol/L��������Ũ���������ˮ����500 mL���ʵ���Ũ��Ϊ0.400 mol/L��ϡ���ᡣ��Ҫ��ȡ___________mL����Ũ����������ơ�
��3��100mL0.3mol/LNa2SO4��Һ��50mL0.2mol/LAl2(SO4)3��Һ��Ϻ���Һ��SO42�������ʵ���Ũ��Ϊ__________mol/L
��4����״���£���V L A���壨Ħ������ΪM g/mol������0.1Lˮ(�ܶ�1 g/cm3)�У�������Һ���ܶ�Ϊ![]() �������Һ�����ʵ���Ũ��Ϊ mol/L
�������Һ�����ʵ���Ũ��Ϊ mol/L
A��![]() B��
B��![]() C��
C��![]() D��
D��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������εı�����Һ�У�Ag+Ũ�ȴ�С˳����ȷ���ǣ���֪��Ksp��AgCl��=1.8��10-10��Ksp��AgI��=1.5��10-16��Ksp��AgBr��=7.7��10-13����������
A. AgCl��AgI��AgBr B. AgCl��AgBr��AgI
C. AgBr��AgCl��AgI D. AgBr��AgI��AgCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
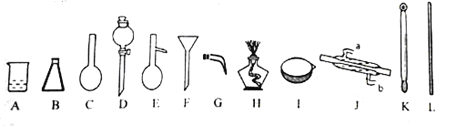
��1����д�������������ƣ�B D E
��2�������Ȼ�̼��ȡ����ˮ��Br2�ķ����ǣ� ����Br2�����Ȼ�̼��Һ��ˮ���뿪�IJ����ǣ�
��3����֪Br2�ķе���58.5�������Ȼ�̼�е���78������Br2�����Ȼ�̼��Һ�е�Br2��������IJ����� ���ò�����Ҫ�õ��IJ��������У�����ĸ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ı������ĸ�������һ��������ƽ����ƶ�
A���¶� B��Ũ�� C��ѹǿ D������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� 1.52 gͭþ�Ͻ���ȫ�ܽ���50 mL�ܶ�Ϊ1.40 g/mL����������Ϊ63%��Ũ�����У��õ�NO2��N2O4�Ļ������1 120 mL(��״��������Ӧ�����Һ�м���1.0 mol/L NaOH��Һ������������ȫ������ʱ���õ�2.54g����������˵������ȷ����
A���úϽ���ͭ��þ�����ʵ���֮����2:1
B����Ũ������HNO3�����ʵ���Ũ����14.0 mol/L
C��NO2��N2O4�Ļ�������У�NO2�����������80%
D���õ�2.54 g����ʱ������NaOH��Һ�������600 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������з�Ӧ���κ��¶��¾����Է����е���( )
A��2N2(g)��O2(g)===2N2O(g)��H����163 kJ��mol��1
B��Ag(s)��![]() Cl2(g)===AgCl(s)��H����127 kJ��mol��1
Cl2(g)===AgCl(s)��H����127 kJ��mol��1
C��HgO(s)===Hg(l)��![]() O2(g) ��H����91 kJ��mol��1
O2(g) ��H����91 kJ��mol��1
D��H2O2(l)=== ![]() O2(g)��H2O(l) ��H����98 kJ��mol��1
O2(g)��H2O(l) ��H����98 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1��4- �����������������о��ۺ����ܼ���ϵ����ѧ���ʵ���Ҫ����,��ҵ�������з����Ʊ�1��4-���������飺

������ʾ��������Ӧ:2R��C��C��H ![]() R��C��C��C��C��R+H2
R��C��C��C��C��R+H2
�ش��������⣺
��1��D�Ĺ����ŵ�����Ϊ_____________________��
��2���ٺ͢۵ķ�Ӧ���ͷֱ�Ϊ____________��_____________��
��3��E�Ľṹ��ʽΪ_________________________________����1 mol E�ϳ�1��4�����������飬��������Ҫ��������________mol��
��4����д����Ӧ�ٵĻ�ѧ����ʽ______________________________��
��5��������C���������Ƶ�ˮ��Һ�м��ȿɵõ�������F,��д��������F�����ᷴӦ�Ļ�ѧ����ʽ______________________________________��
��6�����㻯����G��C��ͬ���칹�壬�������ֻ�����ֲ�ͬ��ѧ�������⣬��Ŀ��Ϊ1:1��д����ṹ��ʽ_______________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com