

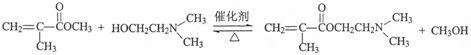
| 催化剂 |
| △ |
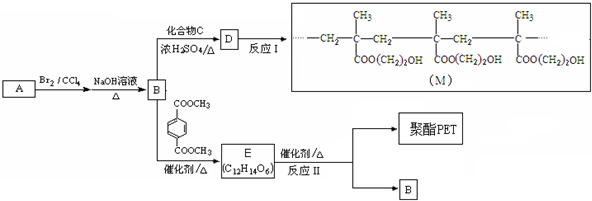
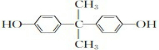 ,A发生取代反应生成C为
,A发生取代反应生成C为 ;由此推出B中必含羧基,X为酚酯.再利用B→D与B→G反应可知B中还含有羟基,其中B→D发生的是消去反应、B→G发生的是酯化反应(生成环酯),B的核磁共振氢谱有三组峰,峰面积比6:1:1,且能与碳酸氢钠溶液反应,说明B中有羧基,可知B的结构简式为:
;由此推出B中必含羧基,X为酚酯.再利用B→D与B→G反应可知B中还含有羟基,其中B→D发生的是消去反应、B→G发生的是酯化反应(生成环酯),B的核磁共振氢谱有三组峰,峰面积比6:1:1,且能与碳酸氢钠溶液反应,说明B中有羧基,可知B的结构简式为: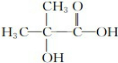 ,再利用反应①(酯的水解反应)和X的分子式,可推出X的结构简式为
,再利用反应①(酯的水解反应)和X的分子式,可推出X的结构简式为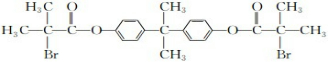 ,进而可利用框图转化,结合有机物的性质由B可推知D为CH2=C(CH3)COOH,E为CH2=C(CH3)COOCH2CH2OH,F为
,进而可利用框图转化,结合有机物的性质由B可推知D为CH2=C(CH3)COOH,E为CH2=C(CH3)COOCH2CH2OH,F为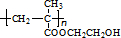 ,G为
,G为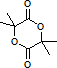 ,据此答题.
,据此答题. ,A发生取代反应生成C为
,A发生取代反应生成C为 ;由此推出B中必含羧基,X为酚酯.再利用B→D与B→G反应可知B中还含有羟基,其中B→D发生的是消去反应、B→G发生的是酯化反应(生成环酯),B的核磁共振氢谱有三组峰,峰面积比6:1:1,且能与碳酸氢钠溶液反应,说明B中有羧基,可知B的结构简式为:
;由此推出B中必含羧基,X为酚酯.再利用B→D与B→G反应可知B中还含有羟基,其中B→D发生的是消去反应、B→G发生的是酯化反应(生成环酯),B的核磁共振氢谱有三组峰,峰面积比6:1:1,且能与碳酸氢钠溶液反应,说明B中有羧基,可知B的结构简式为: ,再利用反应①(酯的水解反应)和X的分子式,可推出X的结构简式为
,再利用反应①(酯的水解反应)和X的分子式,可推出X的结构简式为 ,进而可利用框图转化,结合有机物的性质由B可推知D为CH2=C(CH3)COOH,E为CH2=C(CH3)COOCH2CH2OH,F为
,进而可利用框图转化,结合有机物的性质由B可推知D为CH2=C(CH3)COOH,E为CH2=C(CH3)COOCH2CH2OH,F为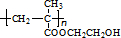 ,G为
,G为 ,
, ,所以B的官能团名称是羟基和羧基,A→C的反应类型是取代反应,
,所以B的官能团名称是羟基和羧基,A→C的反应类型是取代反应, ;取代反应;
;取代反应;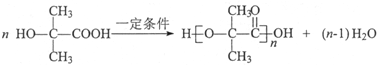 ,
, ;
; 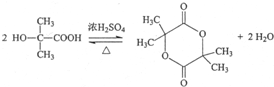 ,
, ;
;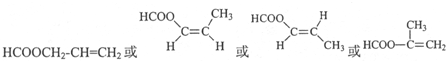 ,共4种(包括顺反异构),其中一种的结构简式为
,共4种(包括顺反异构),其中一种的结构简式为 ,
, ;
; ,
, ;
; ,
, .
.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
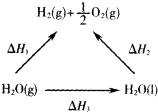
| A、△H1>△H2 |
| B、△H2<△H3 |
| C、△H1=△H2+△H3 |
| D、△H1+△H3>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
18 |
| 催化剂 |
| △ |
18 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | |
| Y | Z |
| A、元素X和元素Y的最高正化合价相同 |
| B、气态氢化物的热稳定性:H2Y<H2X |
| C、Y2Z2是共价化合物 |
| D、酸性:HZO4>H2YO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 180~200℃ |
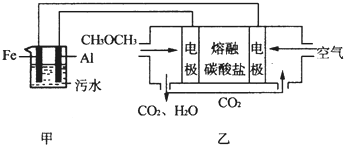
查看答案和解析>>
科目:高中化学 来源: 题型:
 次磷酸(H3PO2)是一种精细化工产品,是一元中强酸,具有较强还原性.
次磷酸(H3PO2)是一种精细化工产品,是一元中强酸,具有较强还原性.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl-OH | 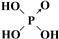 | 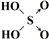 | 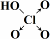 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com