
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.0.1mol·L-1的Na2CO3溶液中含有CO32-的数目一定小于0.1NA
B.用惰性电极电解CuSO4溶液时,阳极产生1.12L(标准状况)气体,则电路中通过的电子数为0.2NA
C.将0.1 molHI完全溶解于1L水中,则溶液中氢原子数为0.1NA
D.一定条件下,某密闭容器中发生反应:N(g)+3H2(g) ![]() 2NH3(g)。该条件下,投入1molN2和3molH2,反应达到平衡时,转移的电子数为6NA
2NH3(g)。该条件下,投入1molN2和3molH2,反应达到平衡时,转移的电子数为6NA
【答案】B
【解析】
A.0.1mol·L-1的Na2CO3溶液,不知道溶液的体积,无法确定CO32-的数目,A错误;
B.用惰性电极电解CuSO4溶液时,阳极反应式为:2H2O-4e-=O2↑+4H+,阳极产生1.12L(标准状况)气体,则阳极产生气体的物质的量为0.05mol,生成一个氧气分子转移4个电子,故阳极产生1.12L(标准状况)气体,则电路中通过的电子数为0.2NA,B正确;
C.将0.1 molHI完全溶解于1L水中,溶剂水中也含有大量的氢原子,C错误;
D.一定条件下,某密闭容器中投入1molN2和3molH2发生反应N(g)+3H2(g) ![]() 2NH3(g),因为这个反应是可逆反应,不能进行完全,故转移的电子数小于6NA,D错误;
2NH3(g),因为这个反应是可逆反应,不能进行完全,故转移的电子数小于6NA,D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】25℃时,有pH为a的盐酸和pH为b的NaOH溶液,取VaL该盐酸与该NaOH溶液中和,需VbLNaOH溶液,问:
(1)若a+b=14,则![]() =___(填数字);
=___(填数字);
(2)若a+b=13,则![]() =___(填数字);
=___(填数字);
(3)若a+b>14,则![]() =___(填表达式)当a≤6,b≥8且a+b=14,则Va___Vb(填“<”、“>”或“=”)。
=___(填表达式)当a≤6,b≥8且a+b=14,则Va___Vb(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年12月20日,美国总统特朗普签署了2020财政年度国防授权法案,对俄罗斯向欧洲进行天然气输出的“北溪2号”管道项目实施制裁,实施“美国优先发展战略”。天然气既是一种优质能源,又是一种重要化工原料,甲烧水蒸气催化重整制备高纯氢是目前的研究热点。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,已知在反应器中存在如下反应过程:
Ⅰ.![]()
Ⅱ.![]()
根据上述信息请写出甲烷水蒸气催化重整的热化学反方程式:________________。
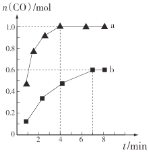
(2)在一定条件下向a、b两个恒温恒容的密闭容器中均通入![]() 和
和![]() ,利用反应Ⅰ制备
,利用反应Ⅰ制备![]() ,测得两容器中CO的物质的量随时间的变化曲线分别为a和b(已知容器a、b的体积为2 L)。
,测得两容器中CO的物质的量随时间的变化曲线分别为a和b(已知容器a、b的体积为2 L)。
则a、b两容器的温度________(填“相同”“不相同”或“不确定”);在达到平衡前,容器a的压强________(填“逐渐增大”“不变”或“逐渐减小”);容器a中![]() 从反应开始到恰好平衡时的平均反应速率为________,在该温度下反应的化学平衡常数K=________。
从反应开始到恰好平衡时的平均反应速率为________,在该温度下反应的化学平衡常数K=________。
(3)某氢氧燃料电池以熔融态的碳酸盐为电解质,其中![]() 参与电极反应。工作时负极的电极反应为
参与电极反应。工作时负极的电极反应为![]() 。如图所示,根据相关信息回答下列问题:
。如图所示,根据相关信息回答下列问题:
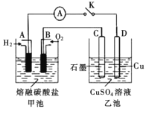
①正极的电极反应为________;
②当甲池中A电极理论上消耗![]() 的体积为448 mL(标准状况)时,乙池中C、D两电极质量变化量之差为________g。
的体积为448 mL(标准状况)时,乙池中C、D两电极质量变化量之差为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁带能在CO2中燃烧,生成氧化镁和单质碳。
(1)碳元素形成的单质有金刚石、石墨、足球烯等。金刚石的熔点远高于足球烯的原因是__________________________。24g金刚石中含有____个碳碳单键。
(2)氧化镁的电子式为_______,CO2的结构式为________。与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为________________,其中能量最高的电子有______个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色植物的光合作用,是地球表面上最普遍的化学变化,也是将___________能转化为________ 能的最主要途径。植物通过光合作用,将二氧化碳和水转化为葡萄糖(C6H12O6),并放出氧气,请写出该反应的化学方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( )

A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的化合物在生产、生活中有广泛应用,其吸收和处理也十分重要。完成下列填空:
(1)SO2具有还原性,可以和许多氧化剂反应。SO2气体通入硫酸酸化的K2Cr2O7溶液中恰好生成铬钾矾[KCr(SO4)2·12H2O]。写出该反应的化学方程式_____________,反应中被还原的元素是__________。
(2)过量的SO2通入Na2S溶液,写出有关的离子方程式____________。
(3)在1L 0.3mol/L的NaOH溶液中,通入4.48LSO2(标况),反应后所得溶液中微粒的浓度之间有一些等量关系,例如:c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),请再写出两个等量关系:_______
(4)在室温下,下列曲线可以描述乙酸(甲、Ki=1.8×10﹣5)和次氯酸(乙、Ki=2.95×10﹣8)在水中的电离度与浓度关系的是_________。
A.
B.
C.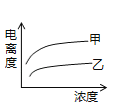
D.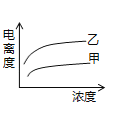
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸的工业制备包括氨的合成、氨的催化氧化及硝酸的浓缩等过程.完成下列计算:
(1)采用甲烷的二次转化法可以制备氢气.
第一次转化的化学方程式:CH4+H2O→CO+3H2;
第二次转化的化学方程式:2CO+CH4+2O2→3CO2+2H2;2CO+O2→2CO2.
现有标准状况下1m3的甲烷,若第一次转化80%,第二次转化20%,经过二次完全转化后可以得到H2__mol.
(2)用饱和K2CO3溶液吸收上述混合气体中的CO2以得到纯净的氢气.处理上述的CO2至少需要饱和K2CO3溶液____g.(已知:20℃K2CO3溶解度:110g/100g水)
(3)已知NH3+2O2→HNO3+H2O.现有氨气1.7吨,不补充水,理论上可制得硝酸的浓度为___%;在该硝酸中加入__吨水最终可得50%的硝酸.
(4)工业上常用98%的浓H2SO4作为制取浓HNO3的脱水剂.63.5%HNO3(质量为M1)中加98%的浓H2SO4(质量为M2)后蒸馏.分别得到97.7%的HNO3和49%的H2SO4溶液(不含HNO3).
①若蒸馏过程中HNO3、H2SO4、H2O均无损耗,求蒸馏前的投料比![]() 的值__(列式计算).
的值__(列式计算).
②蒸馏过程中,若H2O的损耗占总质量的5.0%,即有(M1+M2)×5.0%的H2O流失.则投料时,![]() 比值如何变化,请列式计算说明__.
比值如何变化,请列式计算说明__.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com