
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
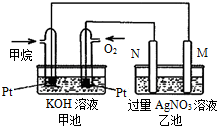 天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式如下,请回答下列问题:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-889.6kJ/mol.
天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式如下,请回答下列问题:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-889.6kJ/mol.查看答案和解析>>
科目:高中化学 来源:2012年苏教版高中化学选修2 2.1氨的合成练习卷(解析版) 题型:简答题
在氨的工业合成中,有三个关键的技术问题,请结合所学知识解决它们。
(1)合成氨的化学原理是N2+3H2??2NH3,在工业上选择20~50 MPa的较高压强和450 ℃左右的温度来进行反应,请结合有关的化学原理解释。
(2)在生产过程中需要大量氢气,现有以下几种获得氢气的方法,请你选出最适宜的,并说明理由。
A.电解水制取氢气
B.由煤或焦炭来制取氢气:煤或焦炭经加热,炽热的炭与水蒸气反应生成氢气
C.由天然气或重油制取氢气:天然气的主要成分甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳;一氧化碳在催化剂存在的条件下与水蒸气反应得到氢气和二氧化碳
(3)合成氨的生产工艺流程:首先用适当的方法生产出合成氨的原料气——氮气和氢气。氮气和氢气的混合气体在合成塔中于一定条件下,通过催化剂的作用产生氨气,再通过氨分离器不断地把生成的氨分离出来,同时未转化的反应气体再进入合成塔循环加工。这就是合成氨的工艺流程。请根据这一描述过程画出流程方框图。
查看答案和解析>>
科目:高中化学 来源:2014届福建省高二第一次月考化学试卷(解析版) 题型:填空题
(8分)天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式是:
CH4(g) + 2O2(g) == CO2(g) + 2H2O(l) ΔH== -889.6kJ/mol
请回答下列问题:
(1)反应物能量总和________(填“大于”、“小于”或“等于”)生成物能量总和。
(2)若1 mol甲烷完全燃烧生成二氧化碳和水蒸气,则放出的热量 (填“>”、“<”或“=”)889.6kJ。
(3)已知氢气燃烧生成液态水的热化学方程式是:2H2(g)+O2(g) ===2H2O(l) ΔH =-572kJ/mol ,则相同质量的甲烷和氢气,完全燃烧生成液态水,放热较多的是________。
(4)如图所示的装置是由CH4 、O2和KOH溶液组成的新型燃料电池,利用该装置可以将 能转化为 能。
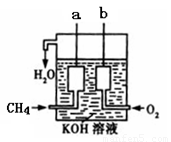
查看答案和解析>>
科目:高中化学 来源:2013届海南省高一下学期第二次月考化学试题(理科) 题型:选择题
已知天然气的主要成分甲烷是一种会产生温室效应的气体,等物质的量的CH4和CO2产生的温室效应,前者大。下面是有关天然气的几种叙述:①天然气与煤、石油相比是比较清洁的能源;②等质量的CH4和CO2产生的温室效应也是前者大;③燃烧天然气也是酸雨的成因之一。其中正确的是( )
A.①②③ B.只有①
C.①和② D.只有③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com