
【题目】短周期主族元素 W、X、Y、Z的原子序数依次增大,X 的最外层电子数是电子层数的2倍,Y和Z位于同一主族。甲、乙、丙为其中三种元素对应的单质,m、n、p均为由这些元素组成的二元化合物, n是一种二元弱酸。上述物质的转化关系如图所示(反应条件省略) 。下列说法正确的是

A.原子半径:W < X < Y
B.W与X组成的化合物中可能含有极性键和非极性键
C.Y与Z组成的化合物一定有漂白性
D.W与X、Y、Z组成的简单化合物的稳定性:X > Y > Z
【答案】B
【解析】
短周期主族元素W、X、Y、Z的原子序数依次增大,X的最外层电子数是电子层数的2倍,X应为C元素,不能是S元素,因为比S原子序数大的短周期主族元素只有Cl,不符合;n是一种二元弱酸,且为二元化合物,则n应为氢化物,结合物质的转化关系,可推得n为H2S,p为SO2,m为H2O,丙为S,甲为H2,乙为O2,则W为H元素,Y为O元素,Z为S元素,据此分析解答。
由以上分析知,W为H元素,X为C元素,Y为O元素,Z为S元素,
A. 同周期元素原子从左至右,原子半径以此减小,则原子半径:W < Y< X,故A错误;
B. W为H元素,X为C元素,二者组成的化合物,如乙烷等,同时含有极性键和非极性键,故B正确;
C. Y为O元素,Z为S元素,二者组成的化合物中,二氧化硫具有漂白性,而三氧化硫不具有漂白性,故C错误;
D. 非金属性越强,其对应的简单氢化物越稳定,非金属性:O>S>C,则W与X、Y、Z组成的简单化合物的稳定性:Y>Z>X,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】化学反应可视为旧键的断裂和新键的形成过程。化学键的键能是形成化学键时释放的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P:198P—O:360O=O:498,则反应P4(白磷)+3O2=P4O6的反应热ΔH为 ( )

A. -1638 kJ·mol-1B. +1638 kJ·mol-1C. -126 kJ·mol-1D. +126 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机材料中间体。实验室由芳香化合物A制备H的一种合成路线如下;
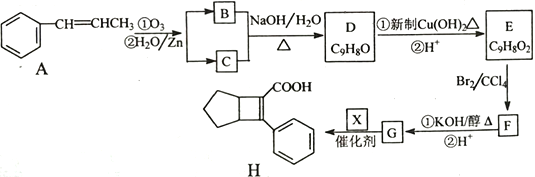
已知:①![]()
②
③![]()
请回答下列问题:
(1)芳香族化合物B的名称为__________,C的同系物中相对分子质量最小的结构简式为__________。
(2)由F生成G的第①步反应类型为_______________。
(3)X的结构简式为_______________。
(4)写出D生成E的第①步反应化学方程式____________________________。
(5)G与乙醇发生酯化反应生成化合物Y,Y有多种同分异构体,其中符合下列条件的同分异构体有__________种,写出其中任意一种的结构简式_____________________。
①分子中含有苯环,且能与饱和碳酸氢钠溶液反应放出CO2
②其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1。
(6)写出用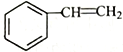 为原料制备化合物
为原料制备化合物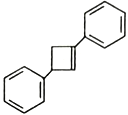 的合成路线,其它无机试剂任选_____________________________________________。
的合成路线,其它无机试剂任选_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图,下列有关奎尼酸的说法中正确的是
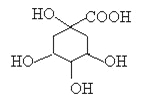
A.奎尼酸的分子式是C7H9O6
B.1mol奎尼酸与足量NaOH溶液反应,最多消耗NaOH物质的量为5mol
C.1 mol奎尼酸与足量钠反应生成56L氢气
D.奎尼酸能发生消去反应,也能与乙醇、乙酸发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数为NA,下列叙述正确的是( )
A.10g氖气所含原子数为NA
B.在D218O中,质量数之和是质子数之和的两倍
C.28g由C2H4和C3H6组成的混合物中,H原子的数目为4NA
D.标况下22.4L正戊烷含氢原子数为12NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含![]() 废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的
废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的![]() 和
和![]() 可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
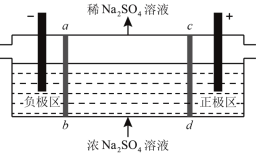
A.负极反应为2H2O-4e-=O2+4H+,负极区溶液![]() 降低
降低
B.通电后中间隔室的SO42-离子向正极迁移,正极区溶液![]() 增大
增大
C.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
D.当电路中通过1![]() 电子的电量时,会有1
电子的电量时,会有1![]() 的
的![]() 生成
生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述不正确的是
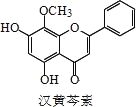
A.汉黄芩素的分子式为 C16H12O5
B.该物质遇 FeCl3 溶液显色
C.1 mol 该物质与溴水反应,最多消耗 2mol Br2
D.与足量 H2 发生加成反应后,该分子中官能团的种类减少 3 种
查看答案和解析>>
科目:高中化学 来源: 题型:
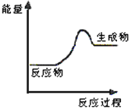
【题目】现有反应:
A.CaCO3![]() CaO+CO2↑
CaO+CO2↑
B.Zn+H2SO4=ZnSO4+H2↑
C.C+CO2![]() 2CO
2CO
D.2KOH+H2SO4=K2SO4+2H2O
(1)上述四个反应中属于氧化还原反应且反应过程中能量变化符合如图的是_______(填反应序号)。
(2)在常温下,上述四个反应中可用于设计原电池的是__________(填反应序号),根据该原电池回答下列问题:
①负极材料是______,负极发生______(填“氧化”或“还原”)反应;正极反应式为_____。
②当导线中有1 mol电子通过时,理论上发生的变化是 _______ (填序号)。
a.溶液增重32.5 g b.溶液增重31.5 g
c.析出1g H2 d.析出11.2LH2
(3) 对于反应B,将足量且等量的形状相同的锌块分别加入到等浓度等体积的两份稀硫酸X、Y中,同时向X中加入少量饱和CuSO4溶液,发生反应生成氢气的体积(V)与时间(t)的关系如图所示。
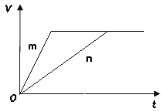
① m曲线表示锌与稀硫酸_________(填“X”或“Y”)反应。
② 锌分别与稀硫酸X、Y反应时,反应速率不同的原因是________(填序号)。
a. CuSO4作催化剂
b.加入硫酸铜溶液增大了c(![]() )
)
c.Zn首先与Cu2+反应,生成的Cu与Zn、稀硫酸构成原电池
d.加入硫酸铜溶液增大了溶液体积
(4)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应2H2 + O2=2H2O设制一个化学电池(材料均用碳棒),回答下列问题:
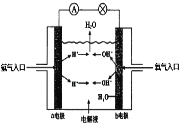
该电池的a极是______,(填正极或负极),若电解质溶液是稀硫酸,则![]() 移向______极,(填a或b),写出b极上的电极反应式________________.
移向______极,(填a或b),写出b极上的电极反应式________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com