
【题目】芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述不正确的是
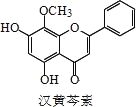
A.汉黄芩素的分子式为 C16H12O5
B.该物质遇 FeCl3 溶液显色
C.1 mol 该物质与溴水反应,最多消耗 2mol Br2
D.与足量 H2 发生加成反应后,该分子中官能团的种类减少 3 种
科目:高中化学 来源: 题型:
【题目】化学反应可视为旧键断裂和新键形成的过程。白磷和P4O6的分子结构如图所示,已知化学键变化时伴随的能量变化是断裂1molP—P吸收198kJ,断裂1molO=O吸收498kJ,形成1molP—O吸收360kJ,则1mol白磷发生反应P4(白磷)+3O2=P4O6放出的能量是( )

A.249kJB.498kJC.996kJD.1638kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 W、X、Y、Z的原子序数依次增大,X 的最外层电子数是电子层数的2倍,Y和Z位于同一主族。甲、乙、丙为其中三种元素对应的单质,m、n、p均为由这些元素组成的二元化合物, n是一种二元弱酸。上述物质的转化关系如图所示(反应条件省略) 。下列说法正确的是

A.原子半径:W < X < Y
B.W与X组成的化合物中可能含有极性键和非极性键
C.Y与Z组成的化合物一定有漂白性
D.W与X、Y、Z组成的简单化合物的稳定性:X > Y > Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常将一定量的有机物充分燃烧转化为简单的无机物,然后根据产物的质量确定有机物的组成。如图所示是用燃烧法确定有机物分子式的常用装置。
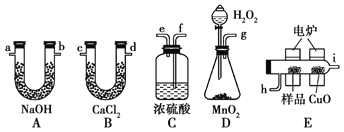
请回答下列问题:
(1)使产生的O2按从左到右的方向流动,则所选装置中各导管的正确连接顺序是________(填字母)。
(2)装置C中浓硫酸的作用是_____________________________________。
(3)燃烧管中CuO的作用是________________________________。
(4)若准确称取0.69 g样品(只含C、H、O三种元素中的两种或三种),充分燃烧后,A管质量增加1.32 g,B管质量增加0.81 g,则该有机物的实验式为________。
(5)要确定该有机物的分子式,还要知道该有机物的____,经测定其蒸气密度为 2.054 g/L(已换算为标准状况),则其分子式为______。
(6)该物质的核磁共振氢谱如图所示,则其结构简式为____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对乙酰氨基酚,俗称扑热息痛(Paracetamol),具有很强的解热镇痛作用,工业上通过下列方法合成(图中B1和B2、C1和C2分别互为同分异构体,无机产物略去):
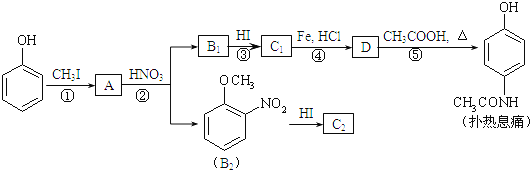
已知:R-NO2![]() R-NH2 请按要求填空:
R-NH2 请按要求填空:
(1)写出A分子中官能团名称:_________;C1的结构简式为:___________________。
(2)写出由D生成扑热息痛的化学方程式:________________________________。
(3)④的反应类型:_____________。
(4)工业上设计反应①、②、③,而不是只通过反应②得到C1、C2,其目的是:_______________________。
(5)扑热息痛有很多同分异构体,符合下列要求的同分异构体有5种:(1)是对位二取代苯;(II)苯环上两个取代基一个含氮不含碳、另一个含碳不含氮;(III)两个氧原子与同一原子相连。其中2种的结构简式是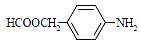 和
和![]() ,写出另3种同分异构体的结构简式____________、____________、____________。
,写出另3种同分异构体的结构简式____________、____________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革 污泥中Cr(III)的处理工艺流程如下。
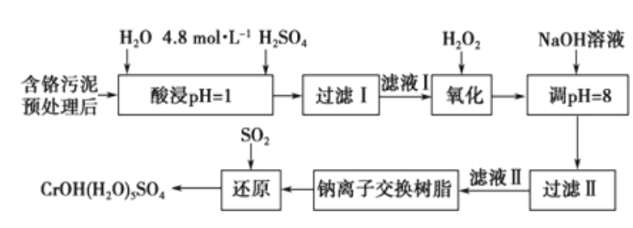
已知:①硫酸浸取后溶液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+;
②CrOH(H2O)5SO4难溶于水。
(1)浓H2O2溶液的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:____________。
(2)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | - | - | - |
沉淀完全时的pH | 3.7 | 11.1 | 5.2 | 5.6 |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为Cr2O42-,其离子方程式为______________________。此步骤中滤液的pH调至8,通过沉淀除去的金属离子为___________;此步骤中没有继续调高将Mg2+除去,理由是______________________。
(3)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用该方法主要除去的滤液II中的Mg2+, 若测得滤液II通过钠离子交换柱后溶液中c(Na+)为amol/L,则滤液II中c(Mg2+)为___________。
(4)写出上述流程中用SO2进行还原时发生反应的离子方程式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,X、Y、Z、W为短周期主族元素,W的原子序数是Z的2倍。下列说法中正确的是
X | Y | Z | ||
W |
A.简单离子半径:Y<Z
B.Y元素的最高价氧化物对应的水化物在一定条件下可以和X单质反应
C.氢化物的沸点:X<Z
D.WZ2具有漂白性,其漂白原理与双氧水相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶液中,还原性HSO3>I-,氧化性IO3->I2。在含有3molNaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法中错误的是
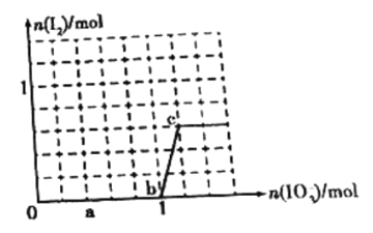
A. a点时NaHSO3剩余
B. b点时还原产物为I-
C. b点到c点,KIO3与NaHSO3反应生成I2
D. 加入的KIO3为0.4mol或1.12mol时,反应后溶液中I-均为0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关短周期主族元素A、B、C、D、E、F的信息如下:
有关信息 | |
A | 其中一种核素的中子数为0 |
B | 最高价氧化物对应的水化物按1:1完全电离出电子数相等的阴、阳离子 |
C | 在地壳中的含量为第三位 |
D | 其单质在O2中燃烧,发出明亮的蓝紫色火焰 |
E | 是形成化合物种类最多的元素 |
F | 其单质常用做保护气体 |
(1)C元素是________(填元素名称),D在元素周期表中的位置是________。
(2)工业上得到C的单质常采用惰性电极电解熔融______(填化学式)的方法,C的单质可以和B的最高价氧化物的水化物发生反应,写出该反应的离子方程式:______。C形成某种化合物LiCA4既是金属储氢材料又是有机合成中的常用试剂,遇水能释放出A2,那么LiCA4中A元素的化合价为_________。
(3)在一定条件下,A与F可形成一种易溶于水的液体F2A4,其电子式为________;该物质可由NaClO与FA3反应制得,写出反应的化学方程式:_______,每生成1mol F2A4转移电子数为________。
(4)写出一个能证明E和F非金属性强弱的化学方程式________。
(5)化合物W由A、D、E、F四种元素组成。向W溶液中滴入FeCl3溶液,溶液变血红色;另取一份W溶液加入强碱溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,W的化学式为________。
(6)F的简单氢化物的沸点比它的同族相邻周期元素氢化物沸点高,理由是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com