
【题目】通常将一定量的有机物充分燃烧转化为简单的无机物,然后根据产物的质量确定有机物的组成。如图所示是用燃烧法确定有机物分子式的常用装置。
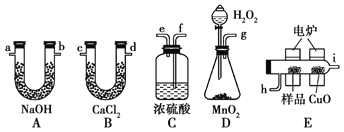
请回答下列问题:
(1)使产生的O2按从左到右的方向流动,则所选装置中各导管的正确连接顺序是________(填字母)。
(2)装置C中浓硫酸的作用是_____________________________________。
(3)燃烧管中CuO的作用是________________________________。
(4)若准确称取0.69 g样品(只含C、H、O三种元素中的两种或三种),充分燃烧后,A管质量增加1.32 g,B管质量增加0.81 g,则该有机物的实验式为________。
(5)要确定该有机物的分子式,还要知道该有机物的____,经测定其蒸气密度为 2.054 g/L(已换算为标准状况),则其分子式为______。
(6)该物质的核磁共振氢谱如图所示,则其结构简式为____。

【答案】 g→f→e→h→i→c(或d)→d(或c)→a(或b)→b(或a) 干燥O2 确保有机物中的碳元素全部转化为CO2 C2H6O 相对分子质量 C2H6O CH3CH2OH
【解析】(1)D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,在E中电炉加热时用纯氧氧化管内样品,生成二氧化碳和水,如有一氧化碳生成,则E中CuO可与CO进一步反应生成二氧化碳,然后分别通入B(吸收水)、A(吸收二氧化碳)中,根据产物的质量推断有机物的组成,则产生的氧气按从左到右流向,所选择装置各导管的连接顺序是g→f→e→h→i→c(或d)→d(或c)→a(或b)→b(或a);(2)D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,以免影响实验结果,即装置C中浓硫酸的作用是干燥O2。(3)一氧化碳能与氧化铜反应,可被氧化成二氧化碳,因此CuO的作用是把有机物不完全燃烧产生的CO转化为CO2;(4)n(CO2)= ![]()
![]() =0.03 mol,n(H2O)=
=0.03 mol,n(H2O)= ![]()
![]() =0.045 mol,m(O)=0.69 g-m(C)-m(H)=0.69 g0.03 mol×12 g·mol-1-0.045 mol×2×1 g·mol-1=0.24 g,n(O)=
=0.045 mol,m(O)=0.69 g-m(C)-m(H)=0.69 g0.03 mol×12 g·mol-1-0.045 mol×2×1 g·mol-1=0.24 g,n(O)= ![]()
![]() =0.015 mol,故其实验式为C2H6O。(5)要确定该有机物的分子式,还要知道该有机物的相对分子质量,M=Vm ρ=22.4 L/mol×2.054 g/L≈46 g/mol,即该有机物的相对分子质量与实验式C2H6O的式量相等,故样品的分子式为C2H6O。(6)由核磁共振氢谱图可知该有机物分子中有三种类型的氢原子,故该有机物的结构简式为CH3CH2OH。
=0.015 mol,故其实验式为C2H6O。(5)要确定该有机物的分子式,还要知道该有机物的相对分子质量,M=Vm ρ=22.4 L/mol×2.054 g/L≈46 g/mol,即该有机物的相对分子质量与实验式C2H6O的式量相等,故样品的分子式为C2H6O。(6)由核磁共振氢谱图可知该有机物分子中有三种类型的氢原子,故该有机物的结构简式为CH3CH2OH。


科目:高中化学 来源: 题型:
【题目】磷化铟和砷化铟纳米晶具备独特的光学和电学特性,广泛应用于生物医学、通信、太阳能电池等领域。回答下列问题:
(1)基态磷原子电子排布式为____________;基态As原子中未成对电子数为__________。
(2)PH3分子空间构型为_______;AsO33-中As原子的杂化方式为____________。
(3)AsH3与NH3在水中溶解度较大的是________,其原因是_________________。
(4)酞菁铟是有机分子酞菁与金属铟形成的复杂分子,结构简式如下图I所示,该分子中存在的化学键为___(填选项字母)。

(5)砷化铟的晶胞绐构如上图II所示,砷化铟晶体的化学式为_______________;该晶胞的棱长为acm,则砷化铟晶体的密度为__________(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的总反应:3Fe2++2S2O32—+O2+x M===Fe3O4+S4O62—+2H2O,有关说法正确的是 ( )
A. 每转移3mol电子,有1.5mol Fe2+被氧化
B. M为OH—离子,x=2
C. O2、S2O32—都是氧化剂
D. 每生成1molFe3O4,反应中转移2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据官能团的不同对下列有机物进行分类。

(1)芳香烃:________;
(2) 卤代烃:________;
(3) 醇:________;
(4)醛:________;
(5)羧酸:________;
(6)酯:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)高铁酸钾![]() 是一种新型、高效、多功能水处理剂。某学习小组设计如下方案制备高铁酸钾:
是一种新型、高效、多功能水处理剂。某学习小组设计如下方案制备高铁酸钾:
![]()
①高铁酸钾中铁元素的化合价为________,据此推测它具有的化学性质是____________。
②其中第一步操作是:在NaClO溶液中加入烧碱固体形成强碱性环境,将研磨过的硝酸铁少量多次地加入上述溶液中,冰水浴中反应1 h。发生的离子反应为2Fe3++3ClO-+10OH-===2FeO![]() +3Cl-+5H2O,还原剂是_____________。
+3Cl-+5H2O,还原剂是_____________。
③高铁酸钾和水发生反应,生成物能吸附杂质净水,同时还产生气体,写出反应的离子方程式:___________________。
(2)某Fe 2(SO4) 3样品含有少量FeSO4杂质,为了测定该样品中铁元素的含量,设计如下实验:
Ⅰ.称取样品m g,加入稀H2SO4,后加水配制成250.00 mL溶液;
Ⅱ.取25.00 mL溶液,先加入![]() ,然后再加过量的氨水,过滤;
,然后再加过量的氨水,过滤;
Ⅲ.将沉淀用蒸馏水洗涤数次后,烘干;
Ⅳ.灼烧至质量不再减少为止,得到红棕色固体,冷却后称量,质量为n g。
请根据上面操作流程,回答以下问题:
①步骤Ⅰ中称量使用的仪器是________________,配制用到的仪器有烧杯、玻璃棒、胶头滴管,还要补充的玻璃仪器是____________________。
②步骤Ⅱ中过滤用的仪器有滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是_________;加入![]() 的主要目的是________________。
的主要目的是________________。
③步骤Ⅲ中检验该沉淀已经洗涤干净的操作是________________。
④若要检验溶液中的![]() ,则应该加入________________试剂。
,则应该加入________________试剂。
⑤计算该样品中铁元素的质量分数的表达式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作、现象与结论均正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3+3KSCN |
B | 向待测液中依次滴入氯水和KSCN溶液 | 溶液变为红色 | 待测液中含有Fe2+ |
C | 向装有X溶液的试管中滴入浓NaOH溶液,将干燥红色石蕊试纸置于试管口 | 无明显现象 | X溶液中无NH4+ |
D | 乙醇和重铬酸钾溶液混合 | 橙色溶液变为绿色 | 乙醇具有还原性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锶有“金属味精”之称。以天青石(主要含有SrSO4和少量CaCO3、MgO杂质)生产氢氧化锶的工艺如下:

已知氢氧化锶在水中的溶解度:
温度(℃) | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
溶解度(g/100mL) | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
(1)隔绝空气焙烧时SrSO4只被还原成SrS,化学方程式为____。
(2)“除杂”方法:将溶液升温至95℃,加NaOH溶液调节pH为12。
①95℃时水的离子积KW=1.0×10-12,Ksp[Mg(OH)2]=1.2×10-10,则溶液中c(Mg2+)=____。
②若pH过大,将导致氢氧化锶的产率降低,请解释原因____。
(3)“趁热过滤”的目的是____,“滤渣”的主要成分为___。
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为____、过滤、洗涤、干燥。
(5)“脱硫”方法:用FeCl3溶液吸收酸浸产生的气体,吸收时的氧化产物为___(填化学式);再用石墨电极电解吸收液,电解后可在“脱硫”中循环利用的物质是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是 ( )

A. 正极反应中有CO2生成
B. 微生物促进了反应中电子的转移
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将0.2 molC(S)和0.3 mol H2O(g)投入2L的密闭容器中,发生反应C(S)+H2O(g)![]() CO + H2 5min达到平衡后,密度增加了0.3g/L。有关下列说法正确的是( )
CO + H2 5min达到平衡后,密度增加了0.3g/L。有关下列说法正确的是( )
A. 从反应开始到平衡过程中,用C来表示该反应的平均速率为0.005 molL-1min-1
B. 达平衡时压强变为原来的7/6
C. 此温度下该反应的平衡常数为0.0125
D. 若保持温度和体积不变,向平衡体系中再加入0.2 molC(S)和0.3 mol H2O(g),重新达到平衡后,H2O的转化率等于16.7%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com