
| A.①② | B.②④⑤ | C.②③④⑤ | D.①③⑥ |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
 CO2 (g)+ H2 (g) △H<0,反应达到平衡后,为提高CO的转化率,可采取的措施有 ,已知1000K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中,c(H2O)﹕c(CO)不低于 ,
CO2 (g)+ H2 (g) △H<0,反应达到平衡后,为提高CO的转化率,可采取的措施有 ,已知1000K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中,c(H2O)﹕c(CO)不低于 , CO2 (g)+ H2 (g),已知c(CO)与反应时间t变化曲线Ⅰ
CO2 (g)+ H2 (g),已知c(CO)与反应时间t变化曲线Ⅰ

 =4,CO2的转化率随时间的变化关系如右图所示.
=4,CO2的转化率随时间的变化关系如右图所示.查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.浓硫酸 | B.碱石灰 | C.NaOH固体 | D.P2O5固体 |
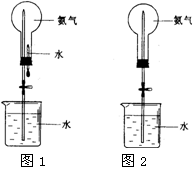
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
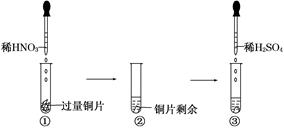
| A.铜片溶解,产生无色气体,该气体遇空气变为红棕色 |
| B.铜片溶解,产生无色气体,该气体遇到空气不变色 |
| C.铜片溶解,放出红棕色有刺激性气味的气体 |
| D.无明显现象,因稀硫酸不与铜反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

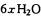 。某化学兴趣小组模拟该处理过程的实验装置如下(夹持装置已略去):
。某化学兴趣小组模拟该处理过程的实验装置如下(夹持装置已略去):
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
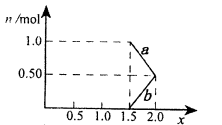
| A.银的质量为10.8g |
| B.NO与NO2的体积比之比(相同条件下)为2:1 |
| C.原硝酸的物质的量浓度 (0.1mol+4b×10-3mol)/0.5L |
| D.沉淀中Cu(OH)2的物质的量为0.05mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
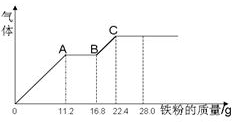
| A.原混合液中NO3-的物质的量为0.4mol |
| B.c(H2SO4)为5mol·L-1 |
| C.溶液中最终溶质为FeSO4 |
| D.OA段产生是NO,AB段反应为2Fe3++Fe = 3Fe2+,BC段产生氢气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com