
【题目】甲烷晶体的晶胞结构如图所示,下列说法正确的是( )
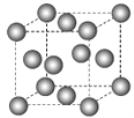
A.甲烷晶胞中的球只代表1个C原子
B.晶体中1个CH4分子周围有12个紧邻的CH4分子
C.甲烷晶体熔化时需克服共价键
D.1个CH4晶胞中含有8个CH4分子
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
【题目】电离平衡常数(Ka、Kb)、水的离子积常数(Kw)、盐的水解常数(Kh)是电解质溶液中的三大常数,学习中我们要注意他们的区别与联系,通过学习的相关知识请完成以下练习。
(1)已知:a.常温下,醋酸和NH3H2O的电离常数相同。
b.CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O
①CH3COONH4溶液呈_______性(填"酸"、"碱"或"中",下同)。
②NH4HCO3溶液呈________性,溶液中物质的量浓度最大的离子是______(填化学式)。
(2)室温时,若用盐酸滴定氨水,当滴定过程中pH=9时,且溶液中满足4c(NH4+)=7c(NH3·H2O),则氨水的电离平衡常数Kb(NH3·H2O)=____________(填数值)。
(3)100℃时,Kw=1.0×10-12,该温度下测得0.1mol/L Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为__________________________________
②该温度下,将0.01mol/L H2A 溶液稀释20倍后,溶液的pH=__________
(4)已知常温下CN-的水解常数Kh=1.61×10-5。常温下,含等物质的量浓度的HCN与NaCN的混合溶液显______(填“酸”、“碱”或“中”)性,c(CN-)_____(填“>”、“<”或“=”)c(HCN)。
学法题:就以上的解答思考,电离平衡常数(Ka)、水的离子积常数(Kw)、盐的水解常数(Kh)之间有什么关系,请写出他们的关系式____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )

A.Z单质与氢气反应较Y剧烈
B.X与W的原子核外电子数相差9
C.X单质氧化性强于Y单质
D.最高价氧化物对应水化物酸性W比Z强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上苯乙烯是合成树脂、离子交换树脂及合成橡胶等的重要单体,如图是苯乙烯的结构简式:![]() ,下列关于该有机物的说法不正确的是( )
,下列关于该有机物的说法不正确的是( )
A. 苯乙烯的分子式为C8H8
B. 苯乙烯通过加聚反应可制备高分子化合物
C. 苯乙烯与溴的四氯化碳溶液反应:![]()
D. 苯乙烯能发生加成反应,但不能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工生产原料,工业上常用硫铁矿焙烧生成SO2,SO2氧化到SO3,再用98.3%左右的浓硫酸吸收SO3得到“发烟”硫酸(H2SO4·SO3)。最后用制得的“发烟”硫酸配制各种不同浓度的硫酸用于工业生产。
完成下列计算:
(1)1kg98%的浓硫酸吸收SO3后,可生产___kg“发烟”硫酸。
(2)“发烟”硫酸(H2SO4·SO3)溶于水,其中SO3都转化为硫酸。若将890g“发烟”硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为___mol/L。
(3)硫铁矿氧化焙烧的化学反应如下:3FeS2+8O2→Fe3O4+6SO24FeS2+11O2→2Fe2O3+8SO2
①1吨含FeS280%的硫铁矿,理论上可生产多少吨98%的浓硫酸__?
②若24molFeS2完全反应耗用氧气1467.2L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量之比___。
(4)用硫化氢制取硫酸,既能充分利用资源又能保护环境,是一种很有发展前途的制备硫酸的方法。硫化氢与水蒸气的混合气体在空气中完全燃烧,再经过催化氧化冷却制得了98%的浓硫酸(整个过程中SO2损失2%,不补充水不损失水)求硫化氢在混合气中的体积分数___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定工业纯碱中Na2CO3的质量分数(含少量NaCl),甲、乙、丙三位学生分别设计了一套实验方案。
学生甲的实验流程如图所示:
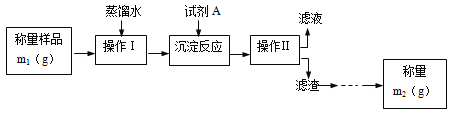
学生乙设计的实验步骤如下:
①称取样品,为1.150g;②溶解后配成250mL溶液;③取20mL上述溶液,加入甲基橙2~3滴;④用0.1140mol/L的标准盐酸进行滴定;⑤数据处理。
回答下列问题:
(1)甲学生设计的定量测定方法的名称是___法。
(2)试剂A可以选用___(填编号)
a.CaCl2 b.BaCl2 c.AgNO3
(3)操作Ⅱ后还应对滤渣依次进行①___、②___两个实验操作步骤。其中,证明前面一步的操作已经完成的方法是___;
(4)学生乙某次实验开始滴定时,盐酸溶液的刻度在0.00mL处,当滴至试剂B由___色至___时,盐酸溶液的刻度在14.90mL处,乙同学以该次实验数据计算此样品中Na2CO3的质量分数是___(保留两位小数)。乙同学的这次实验结果与老师给出的理论值非常接近,但老师最终认定他的实验方案设计不合格,你认为可能的原因是什么?___。
(5)学生丙称取一定质量的样品后,只加入足量未知浓度盐酸,经过一定步骤的实验后也测出了结果。他的实验需要直接测定的数据是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以环戊烷为原料制备环戊二烯的合成路线如图,则下列说法正确的是( )
![]()
A. A的结构简式是![]()
B. ①②的反应类型分别是取代、消去
C. 反应②③的条件分别是浓硫酸加热、光照
D. 加入酸性KMnO4溶液,若溶液褪色则可证明![]() 已完全转化为
已完全转化为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~F都是有机化合物,它们的转化关系如下:
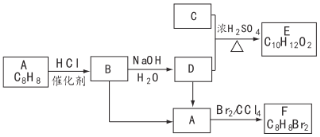
请回答下列问题:
(1)化合物C中含有官能团的名称为________,A为一取代芳香烃,共面的碳原子最多有________个。
(2)D中含有一个甲基,由B生成D的化学方程式为________。
(3)由A生成B的反应类型为________。
(4)由B生成A的反应条件是________。
(5)E存在于栀子香油中,其结构简式为________。
(5)在F的同分异构体中,苯环上一硝化产物只有一种,核磁共振有两组峰且峰面积比为![]() 的是________(填结构简式)。
的是________(填结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)工业合成氨的原理为N2(g)+3H2(g)2NH3(g) H=-92.4kJ·mol-1。现将6molN2和14molH2充入如图所示密闭容器中,保持压强不变,开始时活塞的位置如图1所示,当反应达到平衡时,活塞的位置如图2所示。

①下列表述能说明反应已达到平衡的是___(填字母)。
A.活塞不再移动
B.容器内压强不再改变
C.容器内气体密度不再改变
D.容器内气体的平均相对分子质量不再改变
②已知某次反应过程中逆反应速率随时间的变化关系如图所示,在t1时刻改变了某一条件,则改变的一种条件是_____。

(2)治理NO的一种方法是先将NO氧化成NO2后,再将NO2通入还原性碱溶液中电解转化成N2,其中氧化的反应原理为NO(g)+O3(g)NO2(g)+O2(g) H<0。下列说法正确的是____(填字母)。
A.已知该反应在较低温度下能自发进行,说明S=0
B.加入催化剂,可降低反应的活化能和焓变,从而加快反应的速率
C.活化分子有效碰撞理论中,活化能指活化分子平均能量与非活化分子平均能量的差值
D.在一定温度下,向恒容密闭容器中充入物质的量之比为1:3的NO和O3,达到平衡时NO转化率为a,再充入一定量物质的量之比为1:3的NO和O,NO转化率不变。
(3)处理汽车尾气中的氮氧化物还可以用NH3还原法,假设在恒容密闭容器中,仅发生反应:![]() △H<0。测得NO的平衡转化率随温度的变化关系如图所示,已知温度为T3时,反应达到平衡所需时间为10min。请在图中画出不同温度下(其他条件均相同),反应都经过10min时,NO转化率的曲线示意图_____________。
△H<0。测得NO的平衡转化率随温度的变化关系如图所示,已知温度为T3时,反应达到平衡所需时间为10min。请在图中画出不同温度下(其他条件均相同),反应都经过10min时,NO转化率的曲线示意图_____________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com