
【题目】氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成都需要用氯气.
Ⅰ.工业上通常采用电解法制氯气:观察图1,回答:
(1)电解反应的化学方程式为 .
(2)若饱和食盐水中通电后,b侧产生的气体检验方法是 .
(3)Ⅱ.某学生设计如图2所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),回答下列问题:
在A装置中用固体二氧化锰与浓盐酸,在加热条件下制取氯气,写出反应的化学方程式;
(4)漂白粉将在U形管中产生,其化学方程式是 .
(5)C装置的作用是 .
(6)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应.①温度较高时氯气与消石灰反应生成Ca(ClO3)2 , 为避免此副反应的发生,可采取的措施是 .
②试判断另一个副反应(用化学方程式表示) , 为避免此副反应的发生,可将装置做何改进 .
【答案】
(1)2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(2)移走烧杯,将湿润的淀粉碘化钾试纸放在b导气管口处,若试纸变蓝,则说明产生的气体为Cl2
(3)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(4)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
(5)吸收未反应完的氯气,防止污染空气
(6)冷却B装置,2HCl+Ca(OH)2=CaCl2+2H2O,在A与B之间连接一个装有饱和氯化钠溶液的洗气瓶
【解析】解:I. (1)电解饱和食盐水生成氢氧化钠、氢气和氯气,化学方程式:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
(2)氯气具有强的氧化性,能够氧化碘化钾生成单质碘,碘遇到淀粉变蓝,所以检验氯气的方法为:移走烧杯,将湿润的淀粉碘化钾试纸放在b导气管口处,若试纸变蓝,则说明产生的气体为Cl2;
Ⅱ.(3)浓盐酸与二氧化锰在加热条件下生成氯化锰、氯气和水,化学方程式:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(4)氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水,化学方程式:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(5)氯气有毒,不能直接排放到空气中,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠吸收过量的氯气;
(6)①依据信息可知温度较高时氯气与消石灰反应生成Ca(ClO3)2,为为避免此副反应的发生应该冷却B装置;
②挥发出的氯化氢能够与氢氧化钙发生酸碱中和反应,方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;要避免此反应的发生应该除去氯气中的氯化氢,可以在A与B之间连接一个装有饱和氯化钠溶液的洗气瓶;
所以答案是:(1)2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑;(2)移走烧杯,将湿润的淀粉碘化钾试纸放在b导气管口处,若试纸变蓝,则说明产生的气体为Cl2;(3)MnO2+4HCl(浓)
2NaOH+H2↑+Cl2↑;(2)移走烧杯,将湿润的淀粉碘化钾试纸放在b导气管口处,若试纸变蓝,则说明产生的气体为Cl2;(3)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;(4)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;(5)吸收未反应完的氯气,防止污染空气;(6)①冷却B装置;②2HCl+Ca(OH)2=CaCl2+2H2O;在A与B之间连接一个装有饱和氯化钠溶液的洗气瓶
MnCl2+Cl2↑+2H2O;(4)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;(5)吸收未反应完的氯气,防止污染空气;(6)①冷却B装置;②2HCl+Ca(OH)2=CaCl2+2H2O;在A与B之间连接一个装有饱和氯化钠溶液的洗气瓶
【考点精析】认真审题,首先需要了解氯气的化学性质(氯气的化学性质:与金属反应将金属氧化成高价态;非金属反应;与水反应;与碱反应;与还原性物质反应),还要掌握氯气的实验室制法(实验室制法:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O)的相关知识才是答题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A、B、C都是金属,把A浸入C的盐溶液中,A的表面有C析出,A与B和酸溶液组成原电池时,B为电池的负极。A.B.C金属的活动性顺序为( )
A. A>B>CB. A>C>BC. B>A>CD. B>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2+7H2O反应中.
(1)元素被氧化,是氧化剂.
(2)是氧化产物,发生氧化反应.
(3)在参加反应的盐酸中,起还原剂(被氧化)作用的HCl与起酸性作用的HCl的质量比为 .
(4)用线桥法标明电子转移的方向和数目. .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,溶液的导电性(以电流I表示)滴入的稀硫酸的体积(用V表示)间的关系最接近真实情况的是( )
A.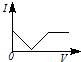
B.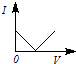
C.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 阴、阳离子间通过静电引力而形成的化学键叫做离子键
B. 只有金属元素和非金属元素化合时才能形成离子键
C. 强碱、大多数盐、氧化物中都含有离子键
D. 离子键一定存在于化合物中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )
A.X是电源的负极
B.阴极的反应式是:H2O+2eˉ=H2+O2-
CO2+2eˉ=CO+O2-
C.总反应可表示为:H2O+CO2![]() H2+CO+O2
H2+CO+O2
D.阴、阳两极生成的气体的物质的量之比是1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。
(1)原子序数为29的铜元素位于元素周期表中第 周期。
(2)某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为 。
(3)研究发现,腐蚀严重的青铜器表面大都存在CuCl。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述正确的是
A.降低了反应的活化能
B.增大了反应的速率
C.降低了反应的焓变
D.增大了反应的平衡常数
(4)采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为
(5)下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。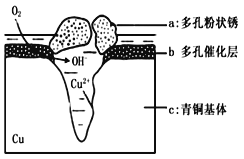
①腐蚀过程中,负极是 (填图中字母“a”或“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为 .
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为 L(标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com