
【题目】在 K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2+7H2O反应中.
(1)元素被氧化,是氧化剂.
(2)是氧化产物,发生氧化反应.
(3)在参加反应的盐酸中,起还原剂(被氧化)作用的HCl与起酸性作用的HCl的质量比为 .
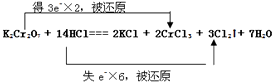
(4)用线桥法标明电子转移的方向和数目. .
【答案】
(1)氯,K2Cr2O7
(2)Cl2,HCl
(3)3:4
(4)
【解析】解:(1)化合价升高的元素是氯元素,被氧化,K2Cr2O7中铬元素的化合价降低,为氧化剂;
(2)化合价升高的氯元素所在的生成物氯气是氧化产物,HCl做还原剂被氧化,发生氧化反应;
(3)起还原剂(被氧化)作用的HCl为6mol,起酸性作用的HCl为8mol,物质的量之比=质量比=3:4;
(4)氧化还原反应的电子转移情况是:  ;
;
故答案为:(1)氯;K2Cr2O7;(2)Cl2、HCl;(3)3:4;(4)
(1)反应过程中,元素化合价升高,则被氧化;有元素化合价降低的物质,为氧化剂。
(2)在反应中,有元素化合价升高的物质,发生氧化反应,所得产物为氧化产物。
(3)在该反应中,被氧化的Cl有6mol,起酸性作用的有8mol。
(4)用双线桥表示电子转移时,应注意箭头指向的为同一种元素,转移电子数可从化合价变化确定。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】原子结构模型的演变图如图:
其中,(1)为道尔顿实心球式原子模型;(2)为卢瑟福行星运转式原子模型;(3)为汤姆生葡萄干面包式原子模型;(4)为近代量子力学原子模型;(5)为玻尔轨道式原子模型.下列符合历史演变顺序的一组排列是( )
A.(1)(3)(2)(5)(4)
B.(1)(2)(3)(4)(5)
C.(1)(5)(3)(2)(4)
D.(1)(3)(5)(4)(2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能够用键能大小解释的是( )
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.相同状态下,氯气的密度比空气的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是(填序号),仪器E的名称是 , 本实验所需玻璃仪器E规格为mL.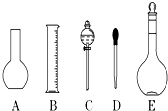
(2)下列操作中,容量瓶所不具备的功能有(填序号).
A.配制一定体积准确浓度的标准溶液
B.长期贮存溶液
C.用来加热溶解固体溶质
D.量取一定体积的液体
(3)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为 mL(计算结果保留一位小数).如果实验室有10mL、25mL、50mL量筒,应选用 mL规格的量筒最好.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成都需要用氯气.
Ⅰ.工业上通常采用电解法制氯气:观察图1,回答:
(1)电解反应的化学方程式为 .
(2)若饱和食盐水中通电后,b侧产生的气体检验方法是 .
(3)Ⅱ.某学生设计如图2所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),回答下列问题:
在A装置中用固体二氧化锰与浓盐酸,在加热条件下制取氯气,写出反应的化学方程式;
(4)漂白粉将在U形管中产生,其化学方程式是 .
(5)C装置的作用是 .
(6)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应.①温度较高时氯气与消石灰反应生成Ca(ClO3)2 , 为避免此副反应的发生,可采取的措施是 .
②试判断另一个副反应(用化学方程式表示) , 为避免此副反应的发生,可将装置做何改进 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有200mL.含KNO3和Cu(NO3)2的混合溶液,其中c(NO3﹣ )=3molL﹣l , 用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24L气体(标准状况).假定电解后溶液体积仍为200mL),下列说法不正确的是( )
A.电解过程中共转移0.4 mol电子
B.原混合液中c(K+)为2.0 molL﹣l
C.电解得到的Cu的质量为6.4 g
D.电解后溶液中c(H+)为0.1 molL﹣l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图.图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( ) 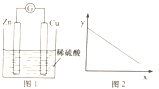
A.铜棒的质量
B.c(Zn2+)
C.c(H+)
D.c(SO42﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com