
k2[c(C)]c[c(D)]dЃЌЦфжа ![]() ЁЂ
ЁЂ![]() ЮЊЫйТЪГЃЪ§ЁЃДяЦНКтЪБ k=
ЮЊЫйТЪГЃЪ§ЁЃДяЦНКтЪБ k=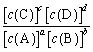 ЃЌЧв
ЃЌЧв![]() ЁЂ
ЁЂ![]() ЁЂkжЛгыЮТЖШгаЙиЁЃЯжНЋ4mol
SO2КЭ2mol O2ГфШыШнЛ§ЮЊ2LЕФУмБеШнЦїжаЃЌ500ЁцНјааЗДгІВЂБЃГжЮТЖШВЛБфЃЌЗДгІДяЦНКтЪБЃЌSO2зЊЛЏТЪЮЊ50%ЁЃдђЃК
ЁЂkжЛгыЮТЖШгаЙиЁЃЯжНЋ4mol
SO2КЭ2mol O2ГфШыШнЛ§ЮЊ2LЕФУмБеШнЦїжаЃЌ500ЁцНјааЗДгІВЂБЃГжЮТЖШВЛБфЃЌЗДгІДяЦНКтЪБЃЌSO2зЊЛЏТЪЮЊ50%ЁЃдђЃК
ЃЈ1ЃЉЦ№ЪМЪБе§ЗДгІЫйТЪЪЧЦНКтЪБЕФ________БЖЁЃ
ЃЈ2ЃЉдк500ЁцЪБИУЗДгІЕФЦНКтГЃЪ§kЪЧ________ЁЃ
ЃЈ3ЃЉдкЮТЖШВЛБфЪБдйЯђЦНКтЬхЯЕжаМгШы2mol SO2ЁЂ2mol O2КЭ4mol SO3ЃЌЦНКтНЋЯђ________вЦЖЏЁЃ

| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃКЮяРэНЬбаЪв ЬтаЭЃК022
2I-+2Fe3+ƒ2Fe2++I2(aq)
ЃЈ1ЃЉИУЗДгІЕФЦНКтГЃЪ§KЕФБэДяЪНЮЊЃКK=________ЃЌЕБЩЯЪіЗДгІДяЕНЦНКтКѓЃЌМгШыCCl4нЭШЁI2ЃЌЧвЮТЖШВЛБфЃЌЩЯЪіЦНКт________вЦЖЏЃЈЬюЁАЯђгвЁБЁЂЁАЯђзѓЁБЛђЁАВЛЁБЃЉЁЃ
ЃЈ2ЃЉЩЯЪіЗДгІЕФе§ЗДгІЫйТЪКЭI-ЁЂFe3+ЕФХЈЖШЙиЯЕЮЊv=kcm(I-)ЁСcn(Fe3+)ЃЈkЮЊГЃЪ§ЃЉ
ХЈЖШгыЗДгІЫйТЪЕФЙиЯЕ
ЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ c(I-)/molЁСL-1ЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ c(Fe3+)/molЁСL-1ЁЁЁЁЁЁЁЁЁЁЁЁ v/
molЁСL-1
ЃЈ1ЃЉЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ 0.20ЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ 0.80ЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ 0.032k
ЃЈ2ЃЉЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ 0.60ЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ 0.40ЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ 0.144k
ЃЈ3ЃЉЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ 0.80ЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ 0.20ЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ 0.128k
ЭЈЙ§ЫљИјЕФЪ§ОнМЦЫуПЩжЊЃК
дкv=kcm(I-)ЁСcn(Fe3+)жаЃЌmЁЂnЕФжЕЮЊЃЈЁЁЃЉ
AЃЎm=1ЃЌn=1ЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ BЃЎm=1ЃЌn=2
CЃЎm=2ЃЌn=1ЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ DЃЎm=2ЃЌn=2
I-ХЈЖШЖдЗДгІЫйТЪЕФгАЯь________Fe3+ХЈЖШЖдЗДгІЫйТЪЕФгАЯьЃЈЬюЁАДѓгкЁБЁЂЁАаЁгкЁБЛђЁАЕШгкЁБЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК022
ЖдгкЗДгІaA+bBƒcC+dDЃЌЗДгІДяЕНЦНКтЪБЃЌK=c(C)cЁСc(D)d/c(A)aЁСc(B)bЃЈKЮЊЦНКтГЃЪ§ЃЉЃЌFe3+КЭI-дкЫЎШмвКжаЕФЗДгІШчЯТЃК
2I-+2Fe3+ƒ2Fe2++I2(aq)
ЃЈ1ЃЉИУЗДгІЕФЦНКтГЃЪ§KЕФБэДяЪНЮЊЃКK=________ЃЌЕБЩЯЪіЗДгІДяЕНЦНКтКѓЃЌМгШыCCl4нЭШЁI2ЃЌЧвЮТЖШВЛБфЃЌЩЯЪіЦНКт________вЦЖЏЃЈЬюЁАЯђгвЁБЁЂЁАЯђзѓЁБЛђЁАВЛЁБЃЉЁЃ
ЃЈ2ЃЉЩЯЪіЗДгІЕФе§ЗДгІЫйТЪКЭI-ЁЂFe3+ЕФХЈЖШЙиЯЕЮЊv=kcm(I-)ЁСcn(Fe3+)ЃЈkЮЊГЃЪ§ЃЉ
ХЈЖШгыЗДгІЫйТЪЕФЙиЯЕ
ЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ c(I-)/molЁСL-1ЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ c(Fe3+)/molЁСL-1ЁЁЁЁЁЁЁЁЁЁЁЁ v/ molЁСL-1ЁСs-1
ЃЈ1ЃЉЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ 0.20ЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ 0.80ЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ 0.032k
ЃЈ2ЃЉЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ 0.60ЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ 0.40ЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ 0.144k
ЃЈ3ЃЉЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ 0.80ЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ 0.20ЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ 0.128k
ЭЈЙ§ЫљИјЕФЪ§ОнМЦЫуПЩжЊЃК
дкv=kcm(I-)ЁСcn(Fe3+)жаЃЌmЁЂnЕФжЕЮЊЃЈЁЁЃЉ
AЃЎm=1ЃЌn=1ЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ BЃЎm=1ЃЌn=2
CЃЎm=2ЃЌn=1ЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ DЃЎm=2ЃЌn=2
I-ХЈЖШЖдЗДгІЫйТЪЕФгАЯь________Fe3+ХЈЖШЖдЗДгІЫйТЪЕФгАЯьЃЈЬюЁАДѓгкЁБЁЂЁАаЁгкЁБЛђЁАЕШгкЁБЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК022
ЖдгкЗДгІaA+bBƒcC+dDЗДгІДяЦНКтЪБЃЌЫВЪБЫйТЪvе§=k1[c(A)]a[c(B)]bЃЌvФц=
k2[c(C)]c[c(D)]dЃЌЦфжа ![]() ЁЂ
ЁЂ![]() ЮЊЫйТЪГЃЪ§ЁЃДяЦНКтЪБ k=
ЮЊЫйТЪГЃЪ§ЁЃДяЦНКтЪБ k=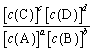 ЃЌЧв
ЃЌЧв![]() ЁЂ
ЁЂ![]() ЁЂkжЛгыЮТЖШгаЙиЁЃЯжНЋ4mol
SO2КЭ2mol O2ГфШыШнЛ§ЮЊ2LЕФУмБеШнЦїжаЃЌ500ЁцНјааЗДгІВЂБЃГжЮТЖШВЛБфЃЌЗДгІДяЦНКтЪБЃЌSO2зЊЛЏТЪЮЊ50%ЁЃдђЃК
ЁЂkжЛгыЮТЖШгаЙиЁЃЯжНЋ4mol
SO2КЭ2mol O2ГфШыШнЛ§ЮЊ2LЕФУмБеШнЦїжаЃЌ500ЁцНјааЗДгІВЂБЃГжЮТЖШВЛБфЃЌЗДгІДяЦНКтЪБЃЌSO2зЊЛЏТЪЮЊ50%ЁЃдђЃК
ЃЈ1ЃЉЦ№ЪМЪБе§ЗДгІЫйТЪЪЧЦНКтЪБЕФ________БЖЁЃ
ЃЈ2ЃЉдк500ЁцЪБИУЗДгІЕФЦНКтГЃЪ§kЪЧ________ЁЃ
ЃЈ3ЃЉдкЮТЖШВЛБфЪБдйЯђЦНКтЬхЯЕжаМгШы2mol SO2ЁЂ2mol O2КЭ4mol SO3ЃЌЦНКтНЋЯђ________вЦЖЏЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
(1)Ц№ЪМЪБе§ЗДгІЫйТЪЪЧЦНКтЪБЗДгІЫйТЪЕФБЖЪ§ЁЃ
(2)дк
(3)дкЮТЖШВЛБфЪБдйЯђЦНКтЬхЯЕжаМгШы2 mol SO2ЁЂ2 mol O2КЭ4 mol SO3ЦНКтНЋЯђФФИіЗНЯђвЦЖЏЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com