
Ε‘”ΎΖ¥”ΠaA+bBƒcC+dDΖ¥”Π¥οΤΫΚβ ±Θ§Υ≤ ±ΥΌ¬ v’ΐ=k1[c(A)]a[c(B)]bΘ§vΡφ=
k2[c(C)]c[c(D)]dΘ§Τδ÷– ![]() ΓΔ
ΓΔ![]() ΈΣΥΌ¬ ≥Θ ΐΓΘ¥οΤΫΚβ ± k=
ΈΣΥΌ¬ ≥Θ ΐΓΘ¥οΤΫΚβ ± k=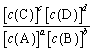 Θ§«“
Θ§«“![]() ΓΔ
ΓΔ![]() ΓΔk÷Μ”κΈ¬Ε»”–ΙΊΓΘœ÷ΫΪ4mol
SO2ΚΆ2mol O2≥δ»κ»ίΜΐΈΣ2LΒΡΟή±’»ίΤς÷–Θ§500ΓφΫχ––Ζ¥”Π≤Δ±Θ≥÷Έ¬Ε»≤Μ±δΘ§Ζ¥”Π¥οΤΫΚβ ±Θ§SO2ΉΣΜ·¬ ΈΣ50%ΓΘ‘ρΘΚ
ΓΔk÷Μ”κΈ¬Ε»”–ΙΊΓΘœ÷ΫΪ4mol
SO2ΚΆ2mol O2≥δ»κ»ίΜΐΈΣ2LΒΡΟή±’»ίΤς÷–Θ§500ΓφΫχ––Ζ¥”Π≤Δ±Θ≥÷Έ¬Ε»≤Μ±δΘ§Ζ¥”Π¥οΤΫΚβ ±Θ§SO2ΉΣΜ·¬ ΈΣ50%ΓΘ‘ρΘΚ
Θ®1Θ©Τπ Φ ±’ΐΖ¥”ΠΥΌ¬ «ΤΫΚβ ±ΒΡ________±ΕΓΘ
Θ®2Θ©‘Ύ500Γφ ±ΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐk «________ΓΘ
Θ®3Θ©‘ΎΈ¬Ε»≤Μ±δ ±‘ΌœρΤΫΚβΧεœΒ÷–Φ”»κ2mol SO2ΓΔ2mol O2ΚΆ4mol SO3Θ§ΤΫΚβΫΪœρ________“ΤΕ·ΓΘ

| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚΈοάμΫΧ―– “ Χβ–ΆΘΚ022
2I-+2Fe3+ƒ2Fe2++I2(aq)
Θ®1Θ©ΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐKΒΡ±μ¥ο ΫΈΣΘΚK=________Θ§Β±…œ ωΖ¥”Π¥οΒΫΤΫΚβΚσΘ§Φ”»κCCl4ίΆ»ΓI2Θ§«“Έ¬Ε»≤Μ±δΘ§…œ ωΤΫΚβ________“ΤΕ·Θ®ΧνΓΑœρ”“Γ±ΓΔΓΑœρΉσΓ±ΜρΓΑ≤ΜΓ±Θ©ΓΘ
Θ®2Θ©…œ ωΖ¥”ΠΒΡ’ΐΖ¥”ΠΥΌ¬ ΚΆI-ΓΔFe3+ΒΡ≈®Ε»ΙΊœΒΈΣv=kcm(I-)ΓΝcn(Fe3+)Θ®kΈΣ≥Θ ΐΘ©
≈®Ε»”κΖ¥”ΠΥΌ¬ ΒΡΙΊœΒ
ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓ c(I-)/molΓΝL-1ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓ c(Fe3+)/molΓΝL-1ΓΓΓΓΓΓΓΓΓΓΓΓ v/
molΓΝL-1
Θ®1Θ©ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓ 0.20ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓ 0.80ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓ 0.032k
Θ®2Θ©ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓ 0.60ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓ 0.40ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓ 0.144k
Θ®3Θ©ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓ 0.80ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓ 0.20ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓ 0.128k
Ά®ΙΐΥυΗχΒΡ ΐΨίΦΤΥψΩ…÷ΣΘΚ
‘Ύv=kcm(I-)ΓΝcn(Fe3+)÷–Θ§mΓΔnΒΡ÷ΒΈΣΘ®ΓΓΘ©
AΘ°m=1Θ§n=1ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓ BΘ°m=1Θ§n=2
CΘ°m=2Θ§n=1ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓ DΘ°m=2Θ§n=2
I-≈®Ε»Ε‘Ζ¥”ΠΥΌ¬ ΒΡ”Αœλ________Fe3+≈®Ε»Ε‘Ζ¥”ΠΥΌ¬ ΒΡ”ΑœλΘ®ΧνΓΑ¥σ”ΎΓ±ΓΔΓΑ–Γ”ΎΓ±ΜρΓΑΒ»”ΎΓ±Θ©ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚΈοάμΫΧ―– “ Χβ–ΆΘΚ022
k2[c(C)]c[c(D)]dΘ§Τδ÷– ![]() ΓΔ
ΓΔ![]() ΈΣΥΌ¬ ≥Θ ΐΓΘ¥οΤΫΚβ ± k=
ΈΣΥΌ¬ ≥Θ ΐΓΘ¥οΤΫΚβ ± k=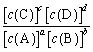 Θ§«“
Θ§«“![]() ΓΔ
ΓΔ![]() ΓΔk÷Μ”κΈ¬Ε»”–ΙΊΓΘœ÷ΫΪ4mol
SO2ΚΆ2mol O2≥δ»κ»ίΜΐΈΣ2LΒΡΟή±’»ίΤς÷–Θ§500ΓφΫχ––Ζ¥”Π≤Δ±Θ≥÷Έ¬Ε»≤Μ±δΘ§Ζ¥”Π¥οΤΫΚβ ±Θ§SO2ΉΣΜ·¬ ΈΣ50%ΓΘ‘ρΘΚ
ΓΔk÷Μ”κΈ¬Ε»”–ΙΊΓΘœ÷ΫΪ4mol
SO2ΚΆ2mol O2≥δ»κ»ίΜΐΈΣ2LΒΡΟή±’»ίΤς÷–Θ§500ΓφΫχ––Ζ¥”Π≤Δ±Θ≥÷Έ¬Ε»≤Μ±δΘ§Ζ¥”Π¥οΤΫΚβ ±Θ§SO2ΉΣΜ·¬ ΈΣ50%ΓΘ‘ρΘΚ
Θ®1Θ©Τπ Φ ±’ΐΖ¥”ΠΥΌ¬ «ΤΫΚβ ±ΒΡ________±ΕΓΘ
Θ®2Θ©‘Ύ500Γφ ±ΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐk «________ΓΘ
Θ®3Θ©‘ΎΈ¬Ε»≤Μ±δ ±‘ΌœρΤΫΚβΧεœΒ÷–Φ”»κ2mol SO2ΓΔ2mol O2ΚΆ4mol SO3Θ§ΤΫΚβΫΪœρ________“ΤΕ·ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ022
Ε‘”ΎΖ¥”ΠaA+bBƒcC+dDΘ§Ζ¥”Π¥οΒΫΤΫΚβ ±Θ§K=c(C)cΓΝc(D)d/c(A)aΓΝc(B)bΘ®KΈΣΤΫΚβ≥Θ ΐΘ©Θ§Fe3+ΚΆI-‘ΎΥ°»ή“Κ÷–ΒΡΖ¥”Π»γœ¬ΘΚ
2I-+2Fe3+ƒ2Fe2++I2(aq)
Θ®1Θ©ΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐKΒΡ±μ¥ο ΫΈΣΘΚK=________Θ§Β±…œ ωΖ¥”Π¥οΒΫΤΫΚβΚσΘ§Φ”»κCCl4ίΆ»ΓI2Θ§«“Έ¬Ε»≤Μ±δΘ§…œ ωΤΫΚβ________“ΤΕ·Θ®ΧνΓΑœρ”“Γ±ΓΔΓΑœρΉσΓ±ΜρΓΑ≤ΜΓ±Θ©ΓΘ
Θ®2Θ©…œ ωΖ¥”ΠΒΡ’ΐΖ¥”ΠΥΌ¬ ΚΆI-ΓΔFe3+ΒΡ≈®Ε»ΙΊœΒΈΣv=kcm(I-)ΓΝcn(Fe3+)Θ®kΈΣ≥Θ ΐΘ©
≈®Ε»”κΖ¥”ΠΥΌ¬ ΒΡΙΊœΒ
ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓ c(I-)/molΓΝL-1ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓ c(Fe3+)/molΓΝL-1ΓΓΓΓΓΓΓΓΓΓΓΓ v/ molΓΝL-1ΓΝs-1
Θ®1Θ©ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓ 0.20ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓ 0.80ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓ 0.032k
Θ®2Θ©ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓ 0.60ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓ 0.40ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓ 0.144k
Θ®3Θ©ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓ 0.80ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓ 0.20ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓ 0.128k
Ά®ΙΐΥυΗχΒΡ ΐΨίΦΤΥψΩ…÷ΣΘΚ
‘Ύv=kcm(I-)ΓΝcn(Fe3+)÷–Θ§mΓΔnΒΡ÷ΒΈΣΘ®ΓΓΘ©
AΘ°m=1Θ§n=1ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓ BΘ°m=1Θ§n=2
CΘ°m=2Θ§n=1ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓ DΘ°m=2Θ§n=2
I-≈®Ε»Ε‘Ζ¥”ΠΥΌ¬ ΒΡ”Αœλ________Fe3+≈®Ε»Ε‘Ζ¥”ΠΥΌ¬ ΒΡ”ΑœλΘ®ΧνΓΑ¥σ”ΎΓ±ΓΔΓΑ–Γ”ΎΓ±ΜρΓΑΒ»”ΎΓ±Θ©ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
(1)Τπ Φ ±’ΐΖ¥”ΠΥΌ¬ «ΤΫΚβ ±Ζ¥”ΠΥΌ¬ ΒΡ±Ε ΐΓΘ
(2)‘Ύ
(3)‘ΎΈ¬Ε»≤Μ±δ ±‘ΌœρΤΫΚβΧεœΒ÷–Φ”»κ2 mol SO2ΓΔ2 mol O2ΚΆ4 mol SO3ΤΫΚβΫΪœρΡΡΗωΖΫœρ“ΤΕ·ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com