
【题目】Ⅰ.在一定温度下,某饱和氢氧化钠溶液体积为V mL,溶液密度为d g·cm-3,质量分数为w,物质的量浓度为c mol·L-1,溶液中含氢氧化钠的质量为m g,该温度下NaOH的溶解度为S。
(1)用w来表示该温度下氢氧化钠的溶解度(S)为______________________________。
(2)用m、V表示溶液中溶质的物质的量浓度(c)为______________________________。
(3)用w、d表示溶液中溶质的物质的量浓度(c)为______________________________。
(4)用c、d表示溶液中溶质的质量分数(w)为___________________________________。
(5)用S、d表示溶液中溶质的物质的量浓度(c)为______________________________。
Ⅱ.已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为____________ mol·L-1。(保留小数点后一位)
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=________ mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是________(填字母)。
A.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
C.需要称量NaClO固体的质量为143.0 g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2 L 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为________ mol·L-1。
②需用浓硫酸的体积为________mL。
【答案】 ![]() g
g ![]() mol·L-1 25dw mol·L-1
mol·L-1 25dw mol·L-1 ![]() %
% ![]() mol·L-1 4.0 0.04 B 4.6 250
mol·L-1 4.0 0.04 B 4.6 250
【解析】Ⅰ. (1)因为溶解度就是在一定温度下的100g水中所能溶解溶质的最大质量,所以 w=![]() ,由此可以求出用w来表示该温度下氢氧化钠的溶解度(S)为
,由此可以求出用w来表示该温度下氢氧化钠的溶解度(S)为![]() g。
g。
(2)n(NaOH)= ![]() ,c=
,c=![]() ,所以用m、V表示溶液中溶质的物质的量浓度(c)为
,所以用m、V表示溶液中溶质的物质的量浓度(c)为![]() mol·L-1。
mol·L-1。
(3)用w、d表示溶液中溶质的物质的量浓度(c)为25dw mol·L-1。
(4)因为c=![]() ,氢氧化钠的摩尔质量是40g/mol,所以用c、d表示溶液中溶质的质量分数(w)为
,氢氧化钠的摩尔质量是40g/mol,所以用c、d表示溶液中溶质的质量分数(w)为 ![]()
![]() %。
%。
(5)把w=![]() 代入 c=
代入 c=![]() ,可得溶质的物质的量浓度(c)为
,可得溶质的物质的量浓度(c)为![]() mol·L-1。
mol·L-1。
Ⅱ.(1)该“84消毒液”中次氯酸钠的物质的量浓度c=![]() =
=![]() mol/L,约为4.0 mol·L-1。
mol/L,约为4.0 mol·L-1。
(2)某同学取100 mL该“84消毒液”,稀释100倍后用于消毒,稀释后的次氯酸钠的物质的量浓度为0.04 mol·L-1,所以稀释后的溶液中c(Na+)=0.04 mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。A.容量瓶用蒸馏水洗净后,不用烘干即能用于溶液配制,A不正确;B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒,则可能有部分次氯酸钠未转移到容量瓶中,可能导致结果偏低,B正确;C. 应选择500mL容量瓶配制500mL溶液,经计算需要次氯酸钠2mol,需要称量NaClO固体的质量为149.0 g,C不正确。所以说法正确的是B。
(4)“84消毒液”与稀酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2 L 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,因为硫酸为二元强酸,所以H+的物质的量浓度为硫酸的2倍,即4.6mol·L-1。
②由浓硫酸的密度和质量分数可以求出其物质的量浓度为![]() mol/L,依据溶液的稀释定律,可以求出需用浓硫酸的体积为
mol/L,依据溶液的稀释定律,可以求出需用浓硫酸的体积为![]() 250mL。
250mL。


科目:高中化学 来源: 题型:
【题目】用如图所示装置及表中的药品(装置I中的试剂足量)并依据装置Ⅱ中的现象,检验混合气体中的某种成分,方案合理的是( )
选项 | 实验目的 | 装置Ⅰ中的试剂 | 装置Ⅱ中的试剂 |
|
A | 检验CO2中混有的CH4 | 澄清石灰水 | 溴水 | |
B | 检验H2S中混有的SO2 | 酸性KMnO4溶液 | 品红溶液 | |
C | 检验溴蒸气中混有的NO2 | CC14 | 石蕊试液 | |
D | 检验HI中混有的HCl | 饱和食盐水 | AgNO3溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++H++OH—+SO42—=BaSO4↓+H2O
B.用铜作电极电解硫酸溶液:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
C.向NaClO溶液中通入过量SO2:ClO—+SO2+H2O=HClO+HSO3—
D.向AlCl3溶液中加入过量的Na:Al3++4Na+2H2O=AlO2—+4Na++2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.标准状况下,两种气体的体积之比等于摩尔质量之比
B.常温常压下,两种气体的物质的量之比等于密度之比
C.同温同压下,两种气体的摩尔质量之比等于密度反比
D.同温同体积时,两种气体的物质的量之比等于压强之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。
用现代分析仪器测定TiO2粒子的大小;用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为:____________________________。
(2)检验TiO2·xH2O中Cl-是否被除净的方法是:____________________________。
(3)可用于测定TiO2粒子大小的方法是____________________(填字母代号)。
a.核磁共振法 b.红外光谱法 c.质谱法 d.透射电子显微镜法
(4)配制NH4Fe(SO4)2标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的_________(填字母代号)。
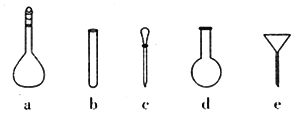
(5)滴定时,称取TiO2(摩尔质量为Mg·mol-1)试样wg,消耗cmol·L-1NH4Fe(SO4)2标准溶液VmL,则TiO2质量分数表达式为____________。
(6)判断下列操作对配制NH4Fe(SO4)2标准溶液的影响(填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,将导致结果______。
②若定容时俯视容量瓶刻线,将导致结果_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与100mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成硫单质2.4g,FeCl2 0.425mol和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是
A. 该磁黄铁矿中FexS的x=0.85
B. 生成的H2S气体在标准状况下的体积为2.24L
C. 100mL的盐酸中HCl物质的量浓度为7.5mol/L
D. 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程如下:

已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用有______________。
A.去除油污 B.溶解镀锌层 C.去除铁锈 D.钝化
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是_____、洗涤、灼烧。
(3)Fe3O4胶体粒子能否用减压过滤法实现固液分离?_____________(填“能”或“不能”),理由是___________________。
(4)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,其原因是________________。
(5)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.01000 mol/L的K2Cr2O7标准溶液250mL,应准确称取_____g K2Cr2O7(保留四位有效数字,已知M(K2Cr2O7)= 294.0 g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关工业生产叙述正确的是
A.电解精炼铜时,将粗铜与电源的负极相连
B.合成氨工业中,将NH3及时液化分离有利于加快反应速率
C.硫酸工业中,采用常压条件的原因是此条件下催化剂活性最高
D.工业上通常使用电解法制备金属钠、镁、铝等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com