


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.Na Mg Al | B.Na K Zn Fe |
| C.Zn Fe Cu Ag | D.Mg Al Zn Fe |
查看答案和解析>>
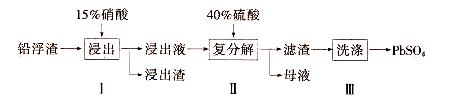
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
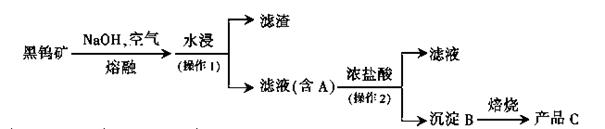
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
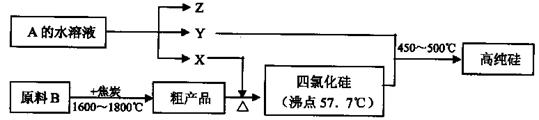
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 金属 | 冶炼原理 |
| A | Fe | Fe2O3+3CO 2Fe+3CO2 2Fe+3CO2 |
| B | Hg | 2HgO 2Hg+O2↑ 2Hg+O2↑ |
| C | Mg | 2MgO(熔融)  2Mg+O2↑ 2Mg+O2↑ |
| D | Na | 2NaCl(熔融)  2Na+Cl2↑ 2Na+Cl2↑ |
查看答案和解析>>
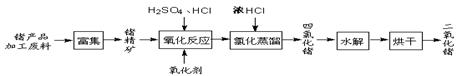
科目:高中化学 来源:不详 题型:填空题
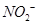 ,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去
,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去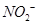 的离子方程式为_____________。
的离子方程式为_____________。| 阳离子 | 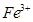 | 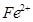 | 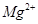 | 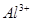 | 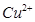 | 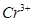 |
| 开始沉淀时的pH | 1.9 | 7.0 | — | — | 4.7 | — |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
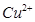 、
、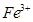 和
和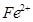 的浓度均为
的浓度均为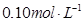 ,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中
,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中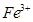 和
和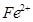 的实验步骤:①__________;②___________;③过滤。(提供的药品:C12、浓
的实验步骤:①__________;②___________;③过滤。(提供的药品:C12、浓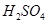 、NaOH溶液、CuO、Cu)。
、NaOH溶液、CuO、Cu)。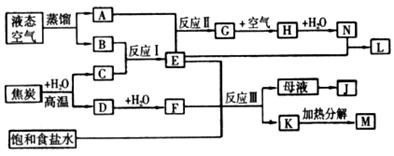
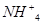 的浓度,使J更多地析出
的浓度,使J更多地析出查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.从海水中提取溴单质的过程中涉及氧化还原反应 |
| B.从海带中提取碘单质的过程中只涉及复分解反应 |
| C.从海水中提取镁单质的过程中要涉及置换反应 |
| D.从海水中提取氯化钠的过程中涉及化学反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com