
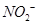 ,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去
,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去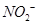 的离子方程式为_____________。
的离子方程式为_____________。| 阳离子 | 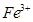 | 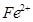 | 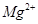 | 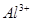 | 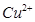 | 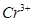 |
| 开始沉淀时的pH | 1.9 | 7.0 | — | — | 4.7 | — |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
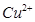 、
、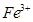 和
和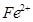 的浓度均为
的浓度均为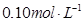 ,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中
,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中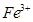 和
和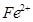 的实验步骤:①__________;②___________;③过滤。(提供的药品:C12、浓
的实验步骤:①__________;②___________;③过滤。(提供的药品:C12、浓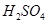 、NaOH溶液、CuO、Cu)。
、NaOH溶液、CuO、Cu)。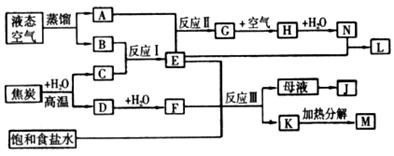
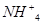 的浓度,使J更多地析出
的浓度,使J更多地析出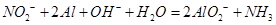 ↑
↑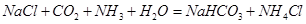 (3分) (4)ac(3分)
(3分) (4)ac(3分)

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源:不详 题型:填空题
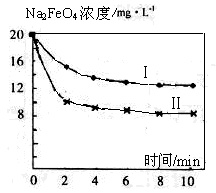
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.作为燃料,为炼铁中的化学反应反应(删去)提供能量 |
| B.作为还原剂与二氧化碳反应产生还原氧化铁的一氧化碳 |
| C.对高炉中的物料起到支撑和疏散的作用 |
| D.作为熔剂,除去铁矿石中的杂质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
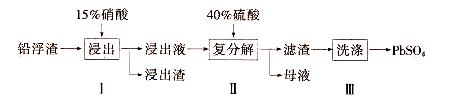
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 冶炼原理 | 方法 |
| A | 2HgO 2Hg + O2 ↑ 2Hg + O2 ↑ | 热分解法 |
| B | 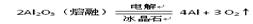 | 电解法 |
| C | Cu2S+ O2 2Cu + SO2 2Cu + SO2 | 热分解法 |
| D | Fe2O3 + 2Al 2 Fe + Al2O3 2 Fe + Al2O3 | 热还原法 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.人类目前直接利用的能量大部分是由化学反应产生的 |
| B.煤、石油、天然气是当今世界重要的三种化石燃料 |
| C.我国目前最主要的能源是煤炭 |
| D.人体运动所消耗的能量与化学反应无关 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原始社会人类学会利用火,他们以天然气取暖,吃熟食,从事生产活动 |
| B.目前我国广大农村生活做饭使用的都是氢能源 |
| C.多能源时代指的是新能源时代,包括核能、太阳能、氢能 |
| D.化石燃料的燃烧没有污染 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用有机溶剂可萃取海水中的溴、碘 |
| B.海水中含有碘元素,只需将海水中的碘升华就可以得到碘单质 |
| C.从海水中可以得到NaCl,NaCl可以是制造化肥的原料 |
| D.常用电解氯化钠和氯化镁的水溶液来制得钠和镁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com