
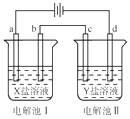
 如图所示的电解池Ⅰ和Ⅱ中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )
如图所示的电解池Ⅰ和Ⅱ中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )| 选项 | X | Y |
| A | MgSO4 | CuSO4 |
| B | CuSO4 | AgNO3 |
| C | FeSO4 | Al2(SO4)3 |
| D | AgNO3 | Pb(NO3)2 |
| A. | A | B. | B | C. | C | D. | D |
分析 电极b、d均为阴极,在它们上面均没有气体逸出,但质量均增大,且增重b<d,则所电解的盐溶液中金属元素应该在金属活动顺序表中(H)以后,转移相同电子时,b析出金属质量小于d,据此分析解答.
解答 解:电极b、d均为阴极,在它们上面均没有气体逸出,但质量均增大,且增重b<d,则所电解的盐溶液中金属元素应该在金属活动顺序表中(H)以后,转移相同电子时,b析出金属质量小于d,阳离子得电子能力如图所示: ,前面的H+表示酸溶液中的H+,后面的H+表示盐溶液中的H+.
,前面的H+表示酸溶液中的H+,后面的H+表示盐溶液中的H+.
A.在金属活动性顺序表中,Mg在H之前,所以电解镁盐溶液时阴极上不能得到金属单质,故A错误;
B.由阳离子得电子能力顺序表可以看出,盐溶液中Ag+和Cu2+的得电子能力均大于H+,因此电解CuSO4溶液阴极b上生成Cu,电解硝酸银溶液时阴极d电极上生成Ag,两池中的电极上转移的电子是相等的,设转移2mol电子,b增重64g,d增重216g,所以质量增加b<d,故B正确;
C.在金属活动性顺序表中,Fe、Al都在H之前,电解亚铁盐、铝溶液溶液时阴极上都不能得到金属单质,故C错误;
D.由阳离子得电子能力顺序表可以看出,盐溶液中Ag+和Pb2+的得电子能力均大于H+,因此电解硝酸银溶液时阴极b电极上生成Ag、电解硝酸铅溶液阴极d上生成Pb,两池中的电极上转移的电子是相等的,设转移2mol电子,b增重216g,d增重207g,所以质量增加b>d,故D错误;
故选B.
点评 本题考查电解原理,同时考查学生对金属活动性顺序表、电解原理的理解及应用,明确离子放电顺序是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2和HCl; Cu(OH)2和CH3COOH | |
| B. | Ba(OH)2和MgSO4; BaCl2和(NH4)2SO4 | |
| C. | Na2CO3和H2SO4; K2CO3和NaHSO4 | |
| D. | CaCO3和HCl; Na2CO3和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,SO2(g)和O2(g)所具有的能量大于SO3(g)所具有的能量 | |
| B. | 将2molSO2(g)和O2(g)置于某密闭容器中充分反应,放出热量为QkJ | |
| C. | 增大压强或升高温度,该平衡都向正反应方向移动 | |
| D. | 若将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热QkJ,则此过程有2molSO2(g)被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(OH)2$\stackrel{Cl_{2}}{→}$Ca(ClO)2$\stackrel{SO_{2}}{→}$HClO | |
| B. | Fe$→_{高温}^{H_{2}O}$Fe2O3$\stackrel{盐酸}{→}$FeCl3 | |
| C. | SO2$\stackrel{NH_{3}•H_{2}O}{→}$NH4HSO3$?_{SO_{2}H_{2}O}^{NH_{3}H_{2}O}$(NH4)2SO3 | |
| D. | FeS2$→_{煅烧}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com