
【题目】从铝土矿(主要成分为Al2O3,还有少量杂质)中提取铝的工艺流程及步骤如下:
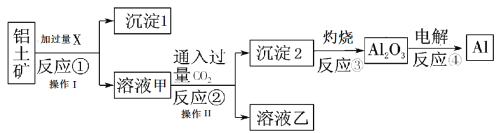
试回答下列问题:
(1)试剂X为_________;反应①的化学方程式为_______________。
(2)操作I 、操作II均为_______(填操作名称)。反应①②③④中属于氧化还原反应的是________(填数字序号)。
(3)反应②的化学方程式为_________________。
(4)金属铝与氧化铁的混合物在高温下会发生剧烈的反应,该反应的化学方程式为___
(5)反应④制取金属铝,若有0.6mol电子发生发生转移,理论上能得到金属铝的质量是________g。
【答案】NaOH溶液 Al2O3+2NaOH=2NaAlO2+H2O 过滤 ④ NaAlO2+CO2(足)+2H2O=Al(OH)3↓+NaHCO3 2Al+Fe2O3![]() Al2O3+2Fe 5.4
Al2O3+2Fe 5.4
【解析】
向铝土矿中加入NaOH溶液,Al2O3反应产生NaAlO2进入溶液甲中,杂质不能反应进入滤渣1中,然后向溶液甲通入过量CO2生成沉淀2为Al(OH)3,加热Al(OH)3发生分解反应产生Al2O3,电解Al2O3生成Al单质。过量试剂X为氢氧化钠溶液,操作①为分离固体和溶液的过滤操作,通入过量二氧化碳过滤得到溶液乙主要为碳酸氢钠,以此解答该题。
(1)根据上述分析可知试剂X为NaOH溶液,氧化铝和氢氧化钠反应生成可溶性的偏铝酸钠和水,反应方程式为:Al2O3+2NaOH=2NaAlO2+H2O,故合理答案为:NaOH;Al2O3+2NaOH=2NaAlO2+H2O;
(2)操作Ⅰ、操作Ⅱ都是分离难溶性固体和溶液的实验操作,名称为过滤,在反应①②③④中,只有④元素的化合价发生了变化,属于氧化还原反应,因此属于氧化还原反应是④,故合理答案为:过滤;④;
(3)反应②是向偏铝酸钠溶液中通入过量二氧化碳生成氢氧化铝沉淀和碳酸氢钠,反应的化学方程式:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;
(4)金属铝与氧化铁混合在高温下,会发生剧烈的反应,生成铁和氧化铝,反应的化学方程式为:2Al+Fe2O3![]() 2Al+Fe2O3;
2Al+Fe2O3;
(5)电解熔融氧化铝制取金属铝,2Al2O3![]() 4Al+3O2↑,反应中电子转移12mol会生成铝4mol,若有0.6mol电子发生转移,理论上能得到金属铝的物质的量是n(Al)=
4Al+3O2↑,反应中电子转移12mol会生成铝4mol,若有0.6mol电子发生转移,理论上能得到金属铝的物质的量是n(Al)=![]() =0.2mol,则产生的Al的质量是m(Al)=0.2mol×27g/mol=5.4g,故答案为:5.4。
=0.2mol,则产生的Al的质量是m(Al)=0.2mol×27g/mol=5.4g,故答案为:5.4。


科目:高中化学 来源: 题型:
【题目】(1)按如图所示操作,充分反应后:
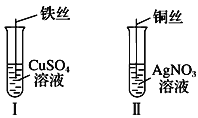
①Ⅰ中发生反应的离子方程式为______________;
②Ⅱ中铜丝上观察到的现象是_____________;
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为________。
(2)黑火药爆炸时发生反应:2KNO3+S+3C=K2S+N2↑+3CO2↑,其中被还原的元素是__,被氧化的元素是____,氧化剂是____,还原剂是__,氧化产物是____,还原产物是_____。
(3)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应物中氧化产物是_____;若反应中转移了0.3 mol电子,则还原产物的质量是____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为![]() 、体积分别为
、体积分别为![]() 和
和![]() 的
的![]() 溶液与
溶液与![]() 溶液按不同体积比混合,保持
溶液按不同体积比混合,保持![]() ,
,![]() 、
、![]() 与混合液的
与混合液的![]() 的关系如图所示。下列说法正确的是( )
的关系如图所示。下列说法正确的是( )
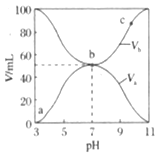
A. ![]()
B. b点,![]()
C. a、b、c三点,c点时水电离出的![]() 最大
最大
D. ![]() 点过程中,可能存在
点过程中,可能存在![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与“物质的量”相关的计算正确的是
A.a g Cl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为![]()
B.28 g CO和22.4 L CO2中含有的碳原子数一定相等
C.标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32
D.现有CO、CO2、O3三种气体,它们分别都含有1 mol O,则三种气体的物质的量之比为3∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是盛放浓硫酸试剂瓶标签上的部分内容。现用该浓硫酸配制240 mL 1.0 mol·L-1的稀硫酸。请回答下列问题:

(1)配制上述稀硫酸时,可供选用的仪器有:①玻璃棒;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦胶头滴管。还缺少的仪器有______________(写仪器名称);
(2)容量瓶上除有刻度线外还应标有____________,在使用前必须检查容量瓶是否____________。
(3)配制240 mL 1.0 mol·L-1的稀硫酸需要用量筒量取上述浓硫酸,量取浓硫酸时应选用以下_____规格的量筒(填选项)。
A.10 mL B.25 mL C.50 mL D.100 mL
(4)配制过程有以下操作:
A.移液 B.量取 C.洗涤 D.定容 E.稀释 F.摇匀 G.计算
其正确的操作顺序应是______________(填序号)。
(5)经过测定,某同学配制的稀硫酸浓度偏低,则可能的原因是_______(填序号)
①用量筒量取浓硫酸时,仰视刻度线
②容量瓶用蒸馏水洗涤后未经干燥
③洗涤烧杯内壁和玻璃棒后将洗涤液倒入废液缸
④转移溶液时,不慎有少量溶液洒出
⑤定容时,俯视容量瓶刻度线
⑥摇匀后发现溶液的凹液面低于刻度线,再加蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用以下流程从铜沉淀渣中回收铜、硒、碲等物质。沉淀渣中除含有铜![]() 、硒
、硒![]() 、碲
、碲![]() 外,还含有少量稀贵金属,主要物质为
外,还含有少量稀贵金属,主要物质为![]() 、
、![]() 和
和![]() 。
。
(1)![]() 、
、![]() 、
、![]() 为同主族元素,其中
为同主族元素,其中![]() 在元素周期表中的位置____。
在元素周期表中的位置____。
其中铜、硒、碲的主要回收流程如图:

(2)经过硫酸化焙烧,铜、硒化铜和碲化铜转变为硫酸铜。
①写出![]() 硫酸化焙烧的化学方程式____。
硫酸化焙烧的化学方程式____。
②“水浸固体”过程中补充少量氯化钠固体,可减少固体中的银(硫酸银)进入浸出液中,结合化学用语,从平衡移动原理角度解释其原因___。
③滤液2经过____、_____、过滤、洗涤、干燥可以得到硫酸铜晶体。
(3)所得粗硒可采用真空蒸馏的方法进行提纯,获得纯硒。真空蒸馏的挥发物中硒含量与温度的关系如图所示。蒸馏操作中控制的最佳温度是____(填序号)。

a.455℃ b.462℃ c.475℃ d.515℃
(4)目前碲化镉薄膜太阳能行业发展迅速,被认为是最有发展前景的太阳能技术之一。用如下装置可以完成碲的电解精炼。研究发现在低的电流密度、碱性条件下,随着![]() 浓度的增加,促进了
浓度的增加,促进了![]() 的沉积。写出
的沉积。写出![]() 的沉积的电极反应式为____。
的沉积的电极反应式为____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气和燃煤尾气是造成空气污染的原因之一。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)十九大报告指出我国最近几年的PM2.5下降很多。有一方面归功于汽车尾气管中加装催化剂,它可有效降低![]() ,
,![]() 及碳氧化合物的排放。以
及碳氧化合物的排放。以![]() 为例,已知:
为例,已知:
①![]()
②![]()
③![]()
④![]()
①②③④反应热效应之间的关系式为![]() ___;有利于提高④
___;有利于提高④![]() 转化率的反应条件是___。
转化率的反应条件是___。
(2)研究发现,将煤炭在![]() 的气氛下燃烧,能够降低燃煤时
的气氛下燃烧,能够降低燃煤时![]() 的排放,主要反应为:
的排放,主要反应为:![]() 。
。
①该反应的平衡常数表达式为____。
②在密闭容器中发生该反应时,![]() 随温度(T)和时间(t)的变化曲线如图1所示。据此判断该反应的
随温度(T)和时间(t)的变化曲线如图1所示。据此判断该反应的![]() ___0(填“>”或“<”),在
___0(填“>”或“<”),在![]() 温度下,
温度下,![]() 内
内![]() 的平均反应速率
的平均反应速率![]() ___。
___。
③将![]() 和
和![]() 充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图2所示。第12min时改变的反应条件可能为___。
充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图2所示。第12min时改变的反应条件可能为___。
A.升高温度 B.加入![]() C.加催化剂 D.降低温度
C.加催化剂 D.降低温度


④将上述反应产生的![]() 与
与![]() 为原料合成尿素,能够实现节能减排:
为原料合成尿素,能够实现节能减排:
Ⅰ:![]() Ⅱ:
Ⅱ:![]()
将一定量的![]() 固体加入恒容密闭容器中,在300K下发生反应Ⅱ,到达平衡时
固体加入恒容密闭容器中,在300K下发生反应Ⅱ,到达平衡时![]() ,
,![]() 为
为![]() ,若反应温度不变,将体系的体积增加50%,一段时间后
,若反应温度不变,将体系的体积增加50%,一段时间后![]() 的取值范围是____(用含a的式子表示)。
的取值范围是____(用含a的式子表示)。
(3)烟气脱硫、脱硝一体化技术是大气污染防治研究的热点。![]() 及
及![]() 均是性能优良的脱硫脱硝试剂。
均是性能优良的脱硫脱硝试剂。
①![]() 在酸性条件下稳定,在
在酸性条件下稳定,在![]() 溶液中可歧化为
溶液中可歧化为![]() 和
和![]() ,该反应的化学方程式为___。
,该反应的化学方程式为___。
②某研究小组用![]() 进行单独脱除
进行单独脱除![]() 实验时,测得
实验时,测得![]() 的脱除率随溶液
的脱除率随溶液![]() 变化如图所示。当
变化如图所示。当![]() 时,随
时,随![]() 的增大,
的增大,![]() 脱除率逐渐降低,其原因是____。
脱除率逐渐降低,其原因是____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于乙醇 在化学反应中断键位置说法错误的是 ( )
在化学反应中断键位置说法错误的是 ( )
A. 乙醇与浓硫酸在170℃时,在②③位置断裂,以水分子的形式消去,属于消去反应。
B. 乙醇与钠反应,在④位置断裂,对比钠与水反应,乙醇比水更难失去氢离子。
C. 乙醇与浓硫酸在140℃时,在③或④位置断裂,该反应属于取代反应。
D. 乙醇在铜催化下与氧气反应,在②④位置断裂,所以只有与羟基直接相连的碳原子上有氢原子才能发生催化氧化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将![]() 溶液滴加到某一元酸(
溶液滴加到某一元酸(![]() )溶液中,测得混合溶液的pH与离子浓度变化关系如图所示。[已知:
)溶液中,测得混合溶液的pH与离子浓度变化关系如图所示。[已知: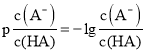 ]。下列叙述正确的是
]。下列叙述正确的是
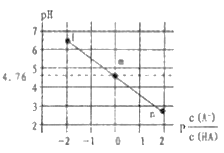
A. ![]() 的数量级为
的数量级为![]()
B. 滴加![]() 溶液过程中,
溶液过程中,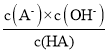 保持不变
保持不变
C. m点所示溶液中:![]()
D. n点所示溶液中:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com