
| n |
| V |


科目:高中化学 来源: 题型:
| A、自然界“水滴石穿”的主要原因用方程式表示为:CaCO3+H2O+CO2═Ca(HCO3)2 |
| B、“雨后彩虹”是与胶体、光学等知识有关的自然现象 |
| C、人类目前直接利用的能量大部分是由化学反应产生的 |
| D、“生物固氮”是指植物通过叶片直接吸收空气中的氮气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
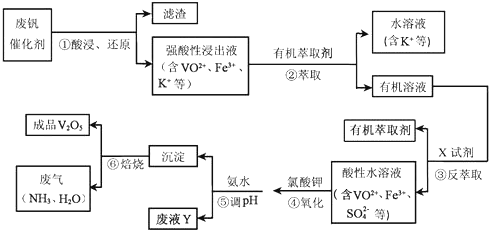
| Ph | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/ | 88 | 92 | 93 | 95 | 95 | 95 | 93 | 90 | 87 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4的摩尔质量为16 |
| B、1 mol H2O的质量为18 g/mol |
| C、同温同压下,气体的密度与气体的相对分子质量成正比 |
| D、在相同温度条件下,气体分子间的平均距离几乎相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、某原子(6个电子、7个中子)的化学符号是
| ||
| B、H2O和CH4分子中具有相同的质子数和原子数 | ||
| C、D和T是氢元素的两种不同的核素 | ||
| D、稀有气体的原子最外层达到稳定结构,故都不能与别的物质发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
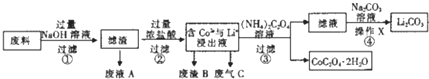
| 编号 | 温度/℃ | 时间/min | 盐酸浓度/mol?L-1 | 钴浸出率/% |
| 1 | 80 | 120 | 3.04 | 97.82 |
| 2 | 80 | 150 | 3.04 | 100.0 |
| 3 | 80 | 180 | 3.04 | 100.0 |
| 4 | 80 | 150 | 2.28 | 100.0 |
| 5 | 80 | 150 | 1.52 | 80.26 |
| 6 | 70 | 150 | 2.28 | 86.85 |
| 7 | 90 | 150 | 2.28 | 100.0 |
| 8 | 80 | 150 | 2.28 | 100.6 |
| 温度/℃ | 0 | 30 | 60 | 90 |
| 浓度/mol?L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a>b | B、a=b |
| C、a<b | D、无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com