
����Ŀ���������������ǵij��д����˼���IJ��㣬����о�NO2��SO2�ȴ�����Ⱦ��Ĵ���������Ҫ���塣
(1)ij�¶��£���֪��
��2SO2(g)+O2(g)![]() 2SO3(g) ��H1=-196.6kJ/mol
2SO3(g) ��H1=-196.6kJ/mol
��2NO(g)+O2(g)![]() 2NO2(g)��H2
2NO2(g)��H2
��NO2(g)+SO2(g)![]() SO3(g)+NO(g) ��H3=-41.8kJ/mol
SO3(g)+NO(g) ��H3=-41.8kJ/mol
���H2= _____________��
(2)��Ͷ�ϱ�2:1��SO2��O2���뵽һ�ܱ������з�����Ӧ2SO2(g)+O2(g)![]() 2SO3(g) �����ƽ��ʱSO2��ת�������¶�T��ѹǿp�Ĺ�ϵ��ͼ����ʾ��
2SO3(g) �����ƽ��ʱSO2��ת�������¶�T��ѹǿp�Ĺ�ϵ��ͼ����ʾ��

��A��B�����Ӧ��ƽ�ⳣ����С��ϵΪKA __________���������������=������ͬ��KB���¶�ΪT,ʱD��vD����vD���Ĵ�С��ϵΪvD�� _____________vD����
��T1�¶���ƽ�ⳣ��Kp=______________ kPa-1��KpΪ�Է�ѹ��ʾ��ƽ�ⳣ�����������������ʽ����
(3)���º����£����ڷ�Ӧ2SO2(g)+O2(g)![]() 2SO3(g)�����ƽ��ʱSO3�������������ʼ
2SO3(g)�����ƽ��ʱSO3�������������ʼ![]() �Ĺ�ϵ��ͼ����ʾ����
�Ĺ�ϵ��ͼ����ʾ����![]() =1.5�ﵽƽ��״̬ʱ��SO2�����������ͼ����D��E��F�����е�____________�㡣A��B����SO2ת���ʵĴ�С��ϵΪaA ___���������������=����aB��
=1.5�ﵽƽ��״̬ʱ��SO2�����������ͼ����D��E��F�����е�____________�㡣A��B����SO2ת���ʵĴ�С��ϵΪaA ___���������������=����aB��
(4)��ҵ�������������ɲ��õ绯ѧ�������е�һ�ַ������ڵ��ģʽ��ֱ�ӷ����������е����ֱ���ڵ��Һ�б����ռ��ڵ缫��Ӧ�б�ת���������ڵ��ģʽ��SO2�����ڵ��Һ�У����ڵ缫��Ӧ������Ϊ���ᣬ�ڴ˷�Ӧ�����пɵõ���������Ϊ40%�����ᡣд��ͨ��SO2�缫�ķ�Ӧʽ��____________����40%��������Һ���հ������(NH4)2SO4��ϡ��Һ����ó����£�����Һ��pH=5����![]() ___________������������һλС������֪���¶���NH3��H2O��Kb=1.7��10-5������������Һ������һ����ˮ��ָ����£���
___________������������һλС������֪���¶���NH3��H2O��Kb=1.7��10-5������������Һ������һ����ˮ��ָ����£���![]() ��ֵ��_____���������䡱��С������
��ֵ��_____���������䡱��С������
���𰸡�-113.0kJ��mol��1 �� �� ![]() D �� SO2-2e��+2H2O=SO42��+4H+ 5.9��10-5 ��С
D �� SO2-2e��+2H2O=SO42��+4H+ 5.9��10-5 ��С
��������
��1���ɸ�˹���ɿɵâ�=��-2���ۼ��㣻
��2������Ӱ��ƽ�ⳣ�������ʵ����ؽ�����������ʽ���㣻
��3������Ͷ�϶Է�Ӧ��Ӱ�������
��4������ʧ���ӣ��ٽ����Һ�Ļ�����ɵ缫��Ӧ�����Kw��Kb���м��㡣
(1)�ɸ�˹���ɿɵâ�=��-2���ۣ����ԡ�H2=��H1��2��H3=-196.6kJ��mol��1-2��(-41.8kJ��mol��1)=-113.0kJ��mol��1��
(2)��2SO2(g)+O2(g)![]() 2SO3(g)��Ӧ���ȣ�ѹǿһ��ʱ���¶�Խ�ͣ�SO2��ת����Խ������T1��T2���÷�Ӧ��ƽ�ⳣ��K���¶����߶����ͣ�����KA��KB���¶�ΪT1ʱD��SO2��ת���ʴ���ƽ��ת���ʣ����Է�Ӧ��Ҫ�����ƶ��ﵽƽ�⣬��v����v����
2SO3(g)��Ӧ���ȣ�ѹǿһ��ʱ���¶�Խ�ͣ�SO2��ת����Խ������T1��T2���÷�Ӧ��ƽ�ⳣ��K���¶����߶����ͣ�����KA��KB���¶�ΪT1ʱD��SO2��ת���ʴ���ƽ��ת���ʣ����Է�Ӧ��Ҫ�����ƶ��ﵽƽ�⣬��v����v����
��ѡȡC�����T1�¶��µ�Kpֵ����SO2����ʼ������Ϊ2mol��
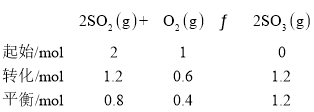
SO2%=![]() ��O2%=
��O2%=![]() ��SO3%=
��SO3%=![]() �����ڷ�ѹ=��ѹ�����ʵ�������������Cƽ�������ʵķ�ѹ�ֱ�Ϊp(SO2)=
�����ڷ�ѹ=��ѹ�����ʵ�������������Cƽ�������ʵķ�ѹ�ֱ�Ϊp(SO2)=![]() pc��p(O2)=
pc��p(O2)=![]() pc��P(SO3)=
pc��P(SO3)=![]() pc��Kp=
pc��Kp=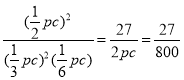 kPa-1��
kPa-1��
��3������Ӧ���Ͷ�ϱȵ��ڷ���ʽ��ϵ���ȼ�![]() =2ʱ��SO3��ƽ���������������Ե�Ͷ�ϱ�
=2ʱ��SO3��ƽ���������������Ե�Ͷ�ϱ�![]() =1.5�ﵽƽ��״̬ʱ��SO3�������������Ͷ�ϱ�
=1.5�ﵽƽ��״̬ʱ��SO3�������������Ͷ�ϱ�![]() =1ʱSO3��ƽ����������Ļ����ϼ�����������Ӧ����D�㣬���ڴ�A��Bֻ������SO2����������SO2ת���ʵĴ�СΪaA��aB��
=1ʱSO3��ƽ����������Ļ����ϼ�����������Ӧ����D�㣬���ڴ�A��Bֻ������SO2����������SO2ת���ʵĴ�СΪaA��aB��
(4)��ΪSO2�ڵ���б����������ᣬ����SO2Ӧ�ôӸ���ͨ�룬����ʧ���ӣ��ٽ����Һ�Ļ�����ɵ缫��Ӧ��SO2-2e��+2H2O=SO42-+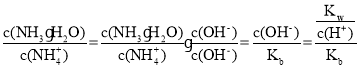 =
=![]() 5.9��10-5����(NH4)2SO4��Һ��Ũ��Ϊc��NH4+��ˮ��̶�Ϊa����
5.9��10-5����(NH4)2SO4��Һ��Ũ��Ϊc��NH4+��ˮ��̶�Ϊa����![]() ��������һ����ˮ��ָ����£���ҺŨ������ˮ��̶ȼ�С��(1-a)����ֵ��С��
��������һ����ˮ��ָ����£���ҺŨ������ˮ��̶ȼ�С��(1-a)����ֵ��С��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A.![]() �Ŀռ乹��Ϊƽ��������
�Ŀռ乹��Ϊƽ��������
B.![]() ��
��![]() ������ԭ�Ӿ�Ϊ
������ԭ�Ӿ�Ϊ![]() �ӻ�
�ӻ�
C.![]() ������
������![]() ����
����![]() ������Ŀ��Ϊ1��1
������Ŀ��Ϊ1��1
D.![]() ����6����ͬ�ijɼ����Ӷ�
����6����ͬ�ijɼ����Ӷ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л���Ӧ���͵������жϲ���ȷ����
ѡ�� | �л���Ӧ | ��Ӧ���� |
A | ����H2��Ӧ���ɻ����� | �ӳɷ�Ӧ |
B | ������������Ϲ��ձ�ը | ȡ����Ӧ |
C | ��ϩ�����CCl4��Һ��Ӧ | ȡ����Ӧ |
D | ��ϩʹ���Ը��������Һ��ɫ | ������Ӧ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£�ˮ�������µ��룺H2O![]() H++OH- H>0������������ȷ����
H++OH- H>0������������ȷ����
A.��ˮ�е�������ϡ���ᣬƽ�������ƶ���Kw��С
B.��ˮ���ȣ�Kw����pH��С
C.��ˮ�м�����������NH4Cl��ƽ�������ƶ���c(H+)����
D.��ˮ�м����������������ƣ�c(H+)=10-7mol/L��Kw����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ZYX4���ڻ�������������ҪӦ�ü�ֵ�����ӻ��������ʽ��ͼ��ʾ��X��Y��Z��ԭ��������������Ķ�����Ԫ�أ�����ֻ��һ��Ϊ����Ԫ�أ�X�����ڱ���ԭ�Ӱ뾶��С��Ԫ�ء����������д������ ( )

A.Z�Ƕ�����Ԫ���н�������ǿ��Ԫ��
B.Y������������Ӧˮ�����������
C.X��Y�����γɷ���ʽΪYX3���ȶ�������
D.������ZYX4��ǿ��ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ĸ���ͬ�������У��ڲ�ͬ����������N2+3H2==2NH3��Ӧ���ϳɰ���������������ͬʱ���ڲⶨ�Ľ���жϣ����ɰ������������� �� ��
A. v(H2)=0.1 mol��(L��min)1B. v(N2)=0.01 mol��(L��s)1
C. v(N2)=0.2 mol��(L��min)1D. v(NH3)=0.3 mol��(L��min)1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.�ںϳɰ���ҵ�У�����NH3����������Ӧ���ʣ����ԭ��ת����
B.�����½��еķ�Ӧ2NO2(g)![]() N2O4(g)��ƽ��ʱ���ݻ��������2mol��NO2�����ٴδﵽƽ��ʱNO2�����������ԭƽ���
N2O4(g)��ƽ��ʱ���ݻ��������2mol��NO2�����ٴδﵽƽ��ʱNO2�����������ԭƽ���
C.�����£�MgO(s)��C(s)��Mg(s)��CO(g)�����Է����У������H��0
D.������pH=2����������H2O�������c(H��)��1.0��10��2mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2002��ŵ������ѧ������ߵĹ���֮һ�Ƿ����˶��л�����ӽ��нṹ�������������䷽�����ü������ģ�10��9g��������ͨ�������ǵ����ӻ���ʹ��Ʒ���Ӵ������ӻ��������������ѳɸ�С�����ӡ���C2H6���ӻ���ɵõ�C2H6����C2H5����C2H4��������Ȼ��ⶨ���ʺɱȡ�ij�л�����Ʒ���ʺɱ�����ͼ��ʾ���������Ӿ���һ����λ����ɣ��ź�ǿ��������ӵĶ����йأ�������л���������� ��
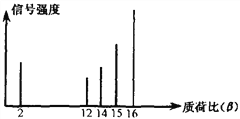

A. �״� B. ���� C. ���� D. ��ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳ�������Ҫ�ɷ���һ����̼�������������ںϳɶ����ѵ����ȼ�ϣ�����Ȼ����úϳ��������п��ܷ����ķ�Ӧ�У�
��CH4(g)+H2O(g)![]() CO(g)+3H2(g) ��H1=+206.1kJ/mol
CO(g)+3H2(g) ��H1=+206.1kJ/mol
��CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ��H2=+247.3kJ/mol
2CO(g)+2H2(g) ��H2=+247.3kJ/mol
��CO(g)+H2O(g)![]() CO2(g)+H2(g) ��H3=��41.2kJ/mol
CO2(g)+H2(g) ��H3=��41.2kJ/mol
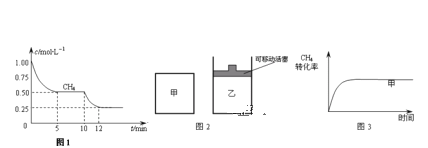
��ش��������⣺
��1����һ�ܱ������н��з�Ӧ�٣����CH4�����ʵ���Ũ���淴Ӧʱ��ı仯��ͼ1��ʾ����Ӧ���е�ǰ5min�ڣ�v (H2)=_____��10minʱ���ı���������������________��
��2����ͼ2��ʾ���ڼס����������зֱ��������ʵ�����CH4��CO2��ʹ�ס�����������ʼ�ݻ���ȣ�����ͬ�¶��·�����Ӧ�ڣ���ά�ַ�Ӧ�������¶Ȳ��䣮��֪��������CH4��ת������ʱ��仯��ͼ����ͼ3��ʾ������ͼ3�л�����������CH4��ת������ʱ��仯��ͼ��_____��
��3��800��ʱ����Ӧ�۵Ļ�ѧƽ�ⳣ��K=1.0��ijʱ�̲�ø��¶��µ��ܱ������и����ʵ����ʵ������±���
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
��ʱ��Ӧ���������淴Ӧ���ʵĹ�ϵʽ��____________(�����)��
a��v(��)��v (��) b��v(��)��v (��)
c��v(��)= v (��) d�����жϣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com