
| A. | 钢 | B. | 陶瓷 | C. | 玻璃 | D. | 二氧化硅 |
科目:高中化学 来源: 题型:选择题
| A. | 将纯水加热到95℃时,Kw变大,pH不变,水仍呈中性 | |
| B. | 向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小 | |
| C. | 向纯水中加入少量氢氧化钠固体,c(H+)减小,Kw不变 | |
| D. | 向纯水中加入盐酸,将抑制水的电离,Kw变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
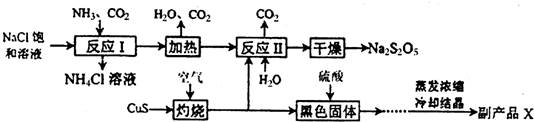
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
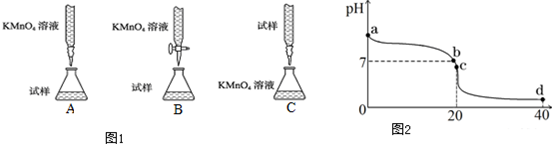
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定次数 | 标准溶液的体积/mL | 待测盐酸溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 1.05 | 21.10 | 15.00 |
| 2 | 2.00 | 21.95 | 15.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4mol电子时铁电极的质量减少11.2g.请回答 下列问题.
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4mol电子时铁电极的质量减少11.2g.请回答 下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 等体积、等物质的量浓度的氨水与盐酸混合 | |
| B. | 常温下,pH=8的氨水与pH=6的硝酸等体积混合 | |
| C. | 常温下,pH=12的Ba(OH)2溶液与pH=2的NaHSO4溶液等体积混合 | |
| D. | c(H+)=c(OH-)=10-6 mol•L-1的溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com