
 .
.分析 A原子最外层p能级的电子数等于次外层的电子数总数,p能级电子数不超过6,则A的核外电子排布为1s22s22p2,故A为碳元素;A、B、C属于同一周期,即位于第二周期,B原子最外层中有两个不成对的电子,核外电子排布式为1s22s22p4,故B为O元素,B元素可分别与A、C、D、E生成RB2型化合物,则C为N元素,可形成NO2化合物;在DB2中D与B的质量比为7:8,则有M(D):2M(O)=7:8,则M(D)=28,故D为Si元素;在EB2中E与B的质量比为1:1,则M(E)=2M(O)=2×16=32,所以E为S元素,据此解答.
解答 解:A原子最外层p能级的电子数等于次外层的电子数总数,p能级电子数不超过6,则A的核外电子排布为1s22s22p2,故A为碳元素;A、B、C属于同一周期,即位于第二周期,B原子最外层中有两个不成对的电子,核外电子排布式为1s22s22p4,故B为O元素,B元素可分别与A、C、D、E生成RB2型化合物,则C为N元素,可形成NO2化合物;在DB2中D与B的质量比为7:8,则有M(D):2M(O)=7:8,则M(D)=28,故D为Si元素;在EB2中E与B的质量比为1:1,则M(E)=2M(O)=2×16=32,所以E为S元素.
(1)D为Si元素,原子序数为14,基态原子的核外电子排布式为1s22s22p63s23p2,
故答案为:1s22s22p63s23p2;
(2)AE2为CS2,为共价化合物,各原子最外层满足8电子稳定结构,电子式 ,
,
故答案为: ;
;
(3)由于N原子2p轨道为半充满状态,能量较大,第一电离能较大,所以第一电离能N>O,
故答案为:N;
(4)C的氢化物为NH3,N原子与H原子形成3个δ键,孤电子对数为$\frac{5-1×3}{2}$=1,价层电子对数为4,VSEPR模型为正四面体,杂化轨道数目为4,N原子的杂化轨道类型为sp3杂化,
故答案为:正四面体;sp3;
(5)C为N元素,形成的单质为N≡N,含有2个π键,由于O的非金属性大于Si,则稳定性:H2O>SiH4,
故答案为:2;H2O;SiH4;
(6)由元素Si组成的单质晶体中,Si原子与周围4个Si原子形成Si-Si,与某个Si原子距离最近的Si原子有4个;二氧化硅晶体中Si原子形成4个Si-O,1mol二氧化硅具有中4molSi-O价,含Si-O键的数目4×6.02×1023,
故答案为:4;4×6.02×1023.
点评 本题是对物质结构的考查,涉及核外电子排布、电子式、价层电子对数理论、杂化发生判断、化学键、晶胞结构等,推断元素是解题关键,注意理解掌握同周期第一电离能异常原因.


科目:高中化学 来源: 题型:选择题
| A. | K+、I-、AlO2-、MnO4- | B. | Na+、S2-、NO3-、SO42- | ||
| C. | Al3+、NH4+、NO3-、F- | D. | K+、Cl-、ClO-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉的主要成分为次氯酸钙 | |
| B. | 实验室可用浓硫酸干燥氨气 | |
| C. | 实验室可用NaOH溶液处理NO2和HCl废气 | |
| D. | 它们对应的含氧酸都是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
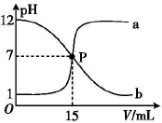
| A. | 盐酸的物质的量浓度与NaOH溶液的物质的量浓度相等 | |
| B. | P点时溶液中c(Na+)=c(Cl-)=c(H+)=c(OH-) | |
| C. | 曲线a是盐酸滴定氢氧化钠溶液的滴定曲线 | |
| D. | 曲线b中滴定前NaOH溶液的体积为150mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | 是一种极性分子易溶于水 | |
| B. | 分子中,每个磷原子以3个共价键结合3个磷原子 | |
| C. | 相对分子质量8倍于白磷分子 | |
| D. | 它和白磷都是磷的同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧杯中一定有铜,可能有铁 | |
| B. | 烧杯中铁铜都有 | |
| C. | 溶液中一定有Fe2+,可能有Cu2+、Fe3+ | |
| D. | 烧杯中有铁无铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com