
【题目】下列反应中,水既不是氧化剂,也不是还原剂,但反应是氧化还原反应的是( )
A. Na2O+H2O=2NaOH B. Cl2+H2O=HCl+HClO
C. C+H2O=CO+H2 D. 2F2+2H2O=4HF+O2
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案科目:高中化学 来源: 题型:
【题目】红矾钠(Na2Cr2O7·2H2O)广泛用作强氧化剂、鞣革剂。以铬矿石(主要成分为Cr2O3,还含有FeO、Al2O3、SiO2等杂质)为原料制取红矾钠的流程如下:

已知:①CrO42-与Cr2O72-存在如下平衡:2CrO42-+2H+![]() Cr2O72-+H2O,当pH<3时,以Cr2O72-为主,当pH>9时,以CrO42-为主。
Cr2O72-+H2O,当pH<3时,以Cr2O72-为主,当pH>9时,以CrO42-为主。
②钠盐在不同温度下的溶解度(g):
温度(℃) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
Na2SO4 | 9.0 | 19.4 | 40.8 | 48.8 | 46.7 | 45.3 | 44.1 | 43.7 |
Na2Cr2O7 | 170.2 | 180.1 | 196.7 | 220.5 | 248.4 | 283.1 | 323.8 | 385.4 |
注32.38℃以上,与饱和溶液平衡的固相为无水Na2SO4,以下则为Na2SO4·10H2O。
③Cr3+完全沉淀时pH为6.8,Cr(OH)3开始溶解时pH为12。
请回答下列问题:
(1)煅烧铬矿石时,生成Na2CrO4的化学反应方程式为_________
(2)滤渣Ⅱ的成分是__________(填化学式)。
(3)有人认为工艺流程中“用稀硫酸调pH”改为“通入过量CO2”,不需调节pH同样可以达到实验效果,理由是___________。
(4)向红矾钠溶液中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到________
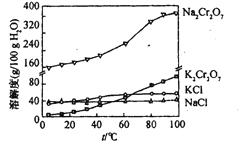
A.80 B.60 C.40 D.10
(5)该工艺所得副产品主要为无水硫酸钠并混有少量重铬酸钠,请设计从副产品获得芒硝(Na2SO4·10H2O)的实验方案:将该副产品按固液质量比100:230溶于热水,加入稍过量的Na2SO3溶液,搅拌,____,过滤,洗涤,低温干燥。(实验中须使用的试剂:稀H2SO4、NaOH溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是
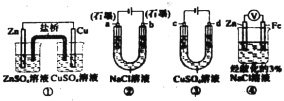
A. 装置①中,盐桥(含有琼胶的KCl饱和溶液)中的K+移向ZnSO4溶液
B. 装置②工作一段时间后,a极附近溶液的pH减小
C. 可以用装置③在铁上镀铜,d极为铜
D. 装置④中发生铁的吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上处理有机废水的一种方法是:在调节好pH和Mn2+浓度的废水中加入H2O2,使有机物氧化降解。现设计如下对比实验(实验条件见下左表),实验测得有机物R浓度随时间变化的关系如下图所示。下列说法正确的是
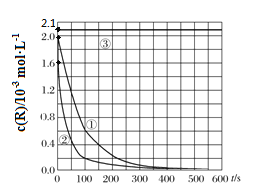
实验编号 | T/K | pH | c/10-3mol·L-1 | |
H2O2 | Mn2+ | |||
① | 298 | 3 | 6.0 | 0.30 |
② | 313 | 3 | 6.0 | 0.30 |
③ | 298 | 9 | 6.0 | 0.30 |
A. 313K时,在0~100s内有机物R降解的平均速率为:0.014 mol·L-1·s-1
B. 对比①②实验,可以得出温度越高越有利于有机物R的降解
C. 对比①②实验,可以发现在两次实验中有机物R的降解百分率不同
D. 通过以上三组实验,若想使反应停止,可以向反应体系中加入一定量的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水质量是关系人类健康的重要问题。
(1)在我国,一些贫困山区的农民至今还饮用井水,但暴雨过后井水混浊,无法饮用。为了能让暴雨过后井水尽快变的澄清,你会建议他们最好向井水中投入下列中的___(填序号)。
A.NaCl B.Na2CO3 C.Kal(SO4)2·12H2O D.CuSO4
(2)氯气是最早用于饮用水消毒的物质,其消毒作用主要是氯气溶于水后生成了次氯酸,该反应的离子方程式为:____________________________
(3)写出工业上制取漂白粉的化学方程式:__________________
(4)臭氧,也称作超氧,可以替代氯气给自来水消毒,即提高了消毒效率且安全无副作用,臭氧的分子式为O3,该物质和次氯酸均可以做漂白剂,二者的漂白原理是:_______________。
(5)某化学活动小组设计实验(装置如图)验证氯、溴、碘及其化合物的有关物质。在硬质玻璃管中的A、B、C三处依次放置湿润的蓝色石蕊试纸、浸有NaBr溶液的棉球、浸有淀粉-KI溶液的棉球(如图所示),由左端通入足量氯气,回答下列问题:
![]()
①观察到的现象
A:__________________;B:__________________;C:__________________
②由上述现象得出的结论氧化性:Cl2 > Br2 > I2,你认为正确吗,为什么? ______________;___________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物N(![]() )可以增强牙膏、口香糖等制品的香气,其中间体L的合成路线如下:
)可以增强牙膏、口香糖等制品的香气,其中间体L的合成路线如下:

已知:R1、R2、R3、R4表示原子或原子团



请回答:
(1)A的官能团名称是______。
(2)B不能发生银镜反应,A→B的化学方程式是______。
(3)C的结构简式是______。
(4)D→F的反应类型是______,F→G的化学方程式是______。
(5)J的结构简式是______。
(6)K含有六原子环结构,K→L的化学方程式是______。
(7)G和L经过3步反应合成N,路线如下:
![]()
结合中间体L的合成路线,写出下列物质的结构简式:
中间产物1:______,中间产物2:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中可发生如下反应:2Mn2++5R2O8 x-+8H2O==16H++10RO42-+2MnO4-,这个反应可定性地检验Mn2+的存在,在反应中充当氧化剂的R2O8x-中,x的值是 ( )
A.0B.1C.2D.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(s)+nB(g)![]() pC(g) △H>O,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定不正确的是
pC(g) △H>O,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定不正确的是
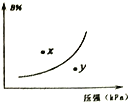
① m+n>p ②x点表示的正反应速率小于逆反应速率 ③n<p
④反应速率x点比y点时的慢 ⑤若升高温度,该反应的平衡常数减小
A. ②⑤ B. ②④ C. ①③ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1.0 mol·L-1的甲溶液中逐滴加入1.0 mol·L-1的乙溶液至过量,产生氢氧化铝沉淀的质量与加入的乙溶液的体积关系如图所示。
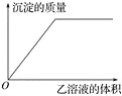
符合图中关系的是下列各组溶液中的( )
A. 甲为氯化铝,乙为氢氧化钠 B. 甲为氢氧化钠,乙为氯化铝
C. 甲为偏铝酸钠,乙为盐酸 D. 甲为氯化铝,乙为氨水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com