
(14分)近年来我国的航天事业取得了巨大的成就,在航天发射时,肼(N2H4)及其衍生物常用作火箭推进剂。
⑴液态肼作火箭燃料时,与液态N2O4混合发生氧化还原反应,已知每1 g肼充分反应后生成气态水放出热量为a KJ,试写出该反应的热化学方程式 。
⑵在实验室中,用N2H4·H2O与NaOH颗粒一起蒸馏,收集114~116 ℃的馏分即为无水肼。
①在蒸馏过程中不需要的仪器是 (填序号字母)。
A.酒精灯 B.长直玻璃导管C.锥形瓶 D.冷凝管
E.牛角管(接液管)F.蒸馏烧瓶 G.酸式滴定管
②除上述必需的仪器外,还缺少的玻璃仪器是 。
⑶肼能使锅炉内壁的铁锈(主要成分Fe2O3)变成磁性氧化铁(Fe3O4)层,可减缓锅炉锈蚀。若反应过程中肼转化为氮气,则每生成1 mol Fe3O4,需要消耗肼的质量为 g。
⑷磁性氧化铁(Fe3O4)的组成可写成FeO·Fe2O3。某化学实验小组通过实验来探究一黑色粉末是否由Fe3O4、CuO组成(不含有其它黑色物质)。探究过程如下:
提出假设:假设1. 黑色粉末是CuO;假设2. 黑色粉末是Fe3O4;
假设3. 。
设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
①若假设1成立,则实验现象是 。
②若所得溶液显血红色,则假设 成立。
③为进一步探究,继续向所得溶液加入足量铁粉,若产生 的现象,则假设3成立。
有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显。
查阅资料:Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3·H2O=Cu(NH3)42++4H2O。
④为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若假设2成立,则产生 现象;若产生 现象,则假设3成立。
⑴N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH=-64a kJ·mol-1
⑵ ①BG ②温度计 ⑶8 g (2,2,1,2)
⑷假设3:黑色粉末是CuO和Fe3O4的混合物
①溶液显蓝色 ②2或3 ③有红色固体析出
④红褐色沉淀 红褐色沉淀,同时溶液呈深蓝色(1,1,1,1,1,2)
【解析】
试题分析:⑴先根据题意写出反应方程式并标出各物质的状态:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g);然后计算出2 mol N2H4参加反应时的反应热 ΔH=-2×32×a=-64a kJ·mol-1,综上便可写出完整的热化学方程式;
⑵蒸馏装置中必须有铁架台、酒精灯、蒸馏烧瓶、温度计、冷凝管、牛角管(接液管) 、锥形瓶等;
⑶根据氧化还原反应的配平原则写出该反应方程式:N2H4+6Fe2O3=4Fe3O4+N2+2H2O,根据反应方程式知每生成1 mol Fe3O4,需要消耗肼的质量为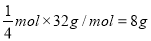 ;
;
⑷根据已知的两个猜想,很容易得出假设3:黑色粉末是CuO和Fe3O4的混合物。
①根据假设1(黑色粉末是CuO),取少量粉末放入足量稀硫酸中,反应生成硫酸铜溶液,在所得溶液中滴加KSCN试剂不与硫酸铜反应,但硫酸铜溶液本身为蓝色。
②若所得溶液显血红色,说明溶液中有Fe3+,即含有Fe3O4,故假设2或3成立;
③要说明假设3成立,即必须证明含有Cu2+,故继续向所得溶液加入足量铁粉,能与其反应生成红色固体(Cu)析出。
④根据信息,要证明即有CuO和Fe3O4,即加入稀硫酸后溶液中含有Fe3+、Cu2+,与足量氨水反应生成Fe(OH)3(红褐色沉淀)和Cu(NH3)42+(深蓝色溶液)。
考 点:本题以“肼(N2H4)”为素材,考查化学实验基础知识和化学实验的探究能力。热化学方程式的书写、蒸馏操作,化学计算(根据方程式),实验探究的假设与验证等。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源:2013-2014浙江省台州市路桥区高考理综化学模拟试卷二试卷(解析版) 题型:选择题
A、B、C、D、E五种短周期元素,它们的原子序数依次增大,最外层电子数之和为19。A的周期数等于族序数,在短周期中D元素的原子半径最大,C与E质子数之比为1︰2,B与C形成的化合物在大气中排放易产生光化学烟雾。则下列说法正确的是 ( )
A.B的气态氢化物稳定性较C的强
B.C与D形成的一种化合物与水反应能产生C2单质
C.均由A、C、D、E四种元素形成的两种盐不能相互反应
D.B的最高价氧化物对应的水化物与其最低价氢化物反应生成的化合物为共价化合物
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省下学期第二次统练高一化学试卷(解析版) 题型:填空题
PMMA俗称有机玻璃,是迄今为止合成透明材料中质地最优异的一种,其合成线路如下图所示:

已知:在一定条件下可以发生如下反应:
(X代表卤素)
回答下列问题:
(1) F的结构简式为 ,所含官能团的名称是 。
(2)写出A的结构简式 , ④的反应类型 。
(3)写出③、⑤反应的化学方程式:
③ ,
⑤ 。
(4)有机物N能使溴水和酸性高锰酸钾褪色,且与有机物M互为同分异构体,请写出满足要求的所有N的结构简式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省下学期第二次统练高一化学试卷(解析版) 题型:选择题
下列反应的化学方程式或离子方程正确的是
A.CH3CH=CH2发生加聚反应: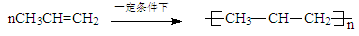
B.乙酸乙酯在酸性条件下水【解析】
C.SO2通入到BaCl2溶液中:SO2+ Ba2++H2O= BaSO3↓+2H+
D.Fe(NO3)2溶液中滴加稀盐酸:3Fe2++4H++NO3- = 3Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省下学期第二次统练高一化学试卷(解析版) 题型:选择题
绿色化学的最大特点在于它是在始端就采用实现污染预防的科学手段,因而过程和终端均为零排放或零污染。绿色化学主张在通过化学转换获取新物质的过程中充分利用每个原子,具有“原子经济性”,因此它既能够充分利用资源,又能够防止污染,下列化学反应,不符合绿色化学概念的是
A.消除硫酸厂尾气排放:SO2+NH3+H2O=(NH4)2SO3
B.消除制硝酸工业尾气的氮氧化物污染:NO2+NO+NaOH=2NaNO2+H2O
C.制CuSO4 :Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D.工业制乙醇 :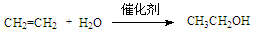
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省五校高三第二次联考理综化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是( )

A.原子半径:rW>rZ>rY>rX
B.含Y元素的盐溶液一定显酸性
C.最简单气态氢化物的热稳定性:Z>W
D.X与氢元素组成的化合物XH5与水反应可产生两种气体
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江宁波市下学期期末全市(八校)联考高一化学试卷(解析版) 题型:填空题
近年来,酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
(1)火力发电厂为除去有害气体SO2,并变废为宝,常采用尾气脱硫工艺,如图所示。写出尾气脱硫工艺中反应的化学方程式: 。

(2)宁波的火力发电厂通常建在海边,一般海水呈弱碱性,主要含有Na+、Mg2+、K+、Ca2+、Cl-、Br-、SO42-、HCO3-等离子。含有SO2的烟气也可以利用海水脱硫,其工艺流程如下图所示:

①向曝气池通入空气的目的是 。
②通入空气后的曝气池中的海水与天然海水相比,浓度有明显不同的离子是 。
A.Cl-B.Na+C.Mg2+D.HCO3-
(3)有人提出了一种利用氯碱工业产品处理含二氧化硫废气的方法,将含SO2的废气通入电解饱和食盐水后所得到的NaOH溶液中,得NaHSO3溶液。写出得到NaHSO3溶液的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江宁波市下学期期末全市(八校)联考高一化学试卷(解析版) 题型:选择题
下列选项中与主族元素在元素周期表中所处的位置相关的是
A.相对原子质量 B.核内中子数
C.次外层电子数 D.电子层数和最外层电子数
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省濮阳市高二下学期升级考试化学试卷(解析版) 题型:填空题
(10分)某科研小组设计出利用工业废酸(l0%)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,如下图所示。

已知:各离子开始沉淀及完全沉淀时的pH如下表所示。

请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS
不溶,则相同温度下:Ksp(CuS)______Ksp(ZnS)(选填“>”“<”或“=”)。
(2)物质A可使用下列物质中的 。
A.KMnO4 B. O2 C.H2O2 D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在________范围之间。
(4)物质B可直接用作氮肥,则B的化学式是________。
(5)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境下将其氧化得到一种高效的多功能水处理剂——K2FeO4,写出该反应的离子方程式__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com