
【题目】配制![]() 溶液。回答下列问题:
溶液。回答下列问题:
(1)需要固体NaCl________g。
(2)配制操作中,一定用不到的玻璃仪器是________![]() 填选项字母
填选项字母![]() 。还缺少的玻璃仪器是________。
。还缺少的玻璃仪器是________。
A.烧杯 ![]() 胶头滴管
胶头滴管 ![]() 玻璃棒
玻璃棒 ![]() 分液漏斗
分液漏斗
(3)若容量瓶中有少量蒸馏水,所配溶液的浓度将________![]() 填“偏大”、“偏小”或“无影响”,下同
填“偏大”、“偏小”或“无影响”,下同![]() ;若定容时仰视加水至刻度线,所配溶液的浓度将________。
;若定容时仰视加水至刻度线,所配溶液的浓度将________。
【答案】1.2 D 100mL容量瓶 无影响 偏小
【解析】
(1)根据n=cV,再根据n=![]() 计算质量;
计算质量;
(2)配制一定量浓度的溶液需要的仪器有容量瓶、天平(或量筒)、烧杯、玻璃棒、胶头滴管;
(3)根据c=![]() 分析判断。
分析判断。
(1)根据n=cV,该溶液中氯化钠的物质的量=0.2mol/L×0.1L=0.02mol,根据n=![]() ,氯化钠的质量=nM=0.02mol×58.5g/mol=1.17g,由于天平的精确度为0.1g,则需要固体NaCl的质量为1.2g;
,氯化钠的质量=nM=0.02mol×58.5g/mol=1.17g,由于天平的精确度为0.1g,则需要固体NaCl的质量为1.2g;
(2)配制一定量浓度的溶液需要的仪器有容量瓶、天平(或量筒)、烧杯、玻璃棒、胶头滴管,一定用不到的玻璃仪器是分液漏斗,配制100mL0.2 mol/L的氯化钠溶液,还缺少的玻璃仪器是100mL容量瓶;
(3)若容量瓶中有少量蒸馏水,对所配溶液的体积无影响,所配溶液的浓度不变;若定容时仰视加水至刻度线,导致所配溶液的体积偏大,物质的量不变,根据c=![]() ,溶液的浓度将偏小。
,溶液的浓度将偏小。


科目:高中化学 来源: 题型:
【题目】如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内液面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中液面继续上升,经过多次重复后,试管内完全充满液体,原来试管中盛装的气体是( )
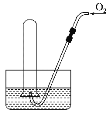
A.可能是N2和NO2的混合气体
B.一定是NO2气体
C.可能是NO与NO2的混合气体
D.只可能是NO2一种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能一步实现的是( )
A. S![]() SO3
SO3![]() H2SO4
H2SO4
B. NH3![]() NO2
NO2![]() HNO3
HNO3
C. Cu2(OH)2CO3![]() CuCl2(aq)
CuCl2(aq)![]() Cu(s)
Cu(s)
D. 饱和NaCl溶液![]() NaHCO3(s)
NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)![]() 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是

A. 图中a点的值为0.15 B. 该反应的平衡常数K=0.03
C. 温度升高,平衡常数K值减小 D. 平衡时A2的转化率为62.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝的利用成为人们研究的热点,是新型电池研发中重要的材料。
(1)通过以下反应制备金属铝。
反应1:Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g);ΔH1=akJ·mol-1
反应2:Al2O3(s)+3C(s)===2Al(l)+3CO(g);ΔH2=bkJ·mol-1
反应3:3AlCl(g)===2Al(l)+AlCl3(g);ΔH3
①反应3的ΔH3=_______kJ·mol-1。
②950℃时,铝土矿与足量的焦炭和Cl2反应可制得AlCl3。该反应的化学方程式是_______。
(2)在高温条件下进行反应:2Al(l)+AlCl3(g)![]() 3AlCl(g)。
3AlCl(g)。
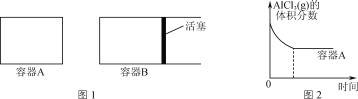
①向图1所示的等容积A、B密闭容器中加入足量的Al粉,再分别充入1 mol AlCl3(g),在相同的高温下进行反应。图2表示A容器内的AlCl3(g)体积分数随时间的变化图,在图2中画出B容器内AlCl3(g)体积分数随时间的变化曲线。__________
②1100℃时,向2 L密闭容器中通入3 mol AlCl(g),发生反应:3AlCl(g)=2Al(l)+AlCl3(g)。已知该温度下AlCl(g)的平衡转化率为80%,则该反应的平衡常数K=________。
③加入3molAlCl(g),在不同压强下发生反应,温度对产率的影响如图3所示。此反应选择温度为900℃的原因是_______________。
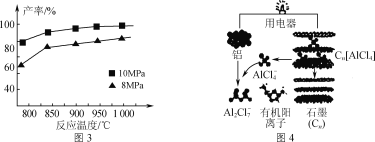
(3)用铝制作的快速放电铝离子二次电池的原理如图4所示。
①该电池充电时,阴极的电极反应式为_____。
②AlCl3和NaCl的熔融盐常用于镀铝电解池,电镀时AlCl4-和Al2Cl7-两种离子在电极上相互转化,其他离子不参与电极反应。NaCl的作用是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水中氨态氮以NH3H2O、NH3和NH4+的形式存在,废水脱氮已成为主要污染物减排和水体富营养化防治的研究热点。
Ⅰ.沉淀法
向废水中投入MgCl2和Na2HPO4,生成MgNH4PO46H2O沉淀,可将氨态氮含量降至10mg·L1以下。
(1)NH3的电子式:______。
(2)废水中的NH3H2O转化为MgNH4PO46H2O的离子方程式是______。

(3)16℃时,向废水中加入MgCl2和Na2HPO4,使镁、氮、磷物质的量之比为1︰1︰1,沉淀过程中的pH对剩余氨态氮浓度的影响如图。欲使剩余氨态氮浓度低于10mg·L1,pH的适宜范围是______,pH偏大或者偏小均不利于MgNH4PO46H2O的生成,原因是______。
Ⅱ.微波—氧化法
(4)仅对废水进行微波加热,pH对氨态氮脱出的影响如下表。
溶液pH | 6~7 | 8~9 | 10~11 | 11~12 |
剩余氨态氮浓度(mg·L1) | 156 | 100 | 40 | 14 |
表中数据表明:pH增大有利于废水中化学平衡______(用化学用语表示)的移动。
(5)微波协同CuO和H2O2除去氨态氮
①其他条件相同,取相同体积的同一废水样品,微波10min,剩余氨态氮浓度与一定浓度H2O2溶液添加量的关系如下图。据图推测CuO在氨态氮脱除中可能起催化作用,理由是______。

②微波协同CuO有利于H2O2除去氨态氮。该条件下,H2O2将NH3氧化为N2的化学方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH= 99 kJ/mol。
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH= 99 kJ/mol。

请回答下列问题:
①图中A点表示:__________________________。
C点表示:______________________________。
E的大小对该反应的反应热______(填“有”或“无”)影响。
②25℃、101 kPa下测得,2mol SO2和1 mol O2充分反应放出热量________198 kJ(填“大于”、“等于”或“小于”)。
(2)由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量(25℃、101 kPa下测得)
①写出该反应的热化学方程式:_____________________________。
②若1 mol水蒸气转化为液态水放热45kJ,则反应H2(g)+![]() O2(g)
O2(g)![]() H2O( l )的ΔH =________________kJ/mol。
H2O( l )的ΔH =________________kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是
A. 甲、乙中都是铝过量 B. 甲中铝过量,乙中碱过量
C. 甲中酸过量,乙中铝过量 D. 甲中酸过量,乙中碱过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是分属三个短周期的主族元素,且原子序数依次增大。A、D同主族,B的氢化物水溶液呈碱性,C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一。用化学用语回答下列问题:
(1)F在元素周期表中的位置为__。
(2)D2E溶液在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。H的电子式为___,写出在空气中长期放置生成H的化学反应方程式为:__。
(3)向30mL某浓度由A、B、C、D中三种元素形成一元强碱溶液通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V[HCl(aq)]的关系有下列图示两种情况(不计CO2的溶解)。

则曲线Y表明M中的溶质为___;原NaOH溶液的物质的量浓度为__;由曲线X、Y可知,两次实验通入的CO2的体积比为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com