
电解CuCl2和NaCl的混合溶液,阴极和阳极上最先分别析出的物质是( )
A.H2和Cl2 B.Cu和Cl2 C. H2和O2 D.Cu和O2
科目:高中化学 来源:2013-2014福建龙岩市毕业联合考试理综化学试卷(解析版) 题型:实验题
(14分)曾经有一种固氮的方法:1100°C通N2和CaC2反应得到CaCN2 。
已知:CaCN2+3H2O = 2NH3+CaCO3 ;CaC2+2H2O = C2H2↑+Ca(OH)2


(1)某同学采用以下装置(加热和夹持仪器已略去)制取少量的CaCN2
①U形管中盛放的物质是 (填一种);
② (填“能”或“不能”)用普通玻璃管代替图中石英管;
(2)检验反应后的固体(用W表示)中含有氮元素该同学将适量W溶于水,有气泡产生,说明固体中含有氮元素,该结论不正确。若要得出正确结论,还需进行的实验是 。
(3)测定W中CaCN2的质量分数
步骤Ⅰ:按如图所示装置(夹持仪器已略去)进行实验:关闭弹簧夹,将漏斗中溶液逐滴加入到三颈瓶中,当W反应完全后,打开弹簧夹,通入氮气,直至氨气被200mL0.1 mol·L-1硫酸完全吸收。
步骤Ⅱ:准确量取烧杯中溶液20.00mL置于锥形瓶中,滴入几滴指示剂,用cmol·L-1NaOH溶液滴定过量的硫酸,实验测得消耗标准溶液的平均体积为vmL。
已知三种常用指示剂变色pH范围如下:
指示剂 | a | b | c |
变色pH范围 | 3.1~4.4 | 8.0~10.0 | 4.4~6.2 |
说明 | pH<3.1显红色 pH>4.4显黄色 | pH<8.0显无色 pH>10.0显红色 | pH<4.4显红色 pH>6.2显黄色 |
①上述滴定过程中,不宜选用的指示剂是 (填字母序号);
②烧杯中最终吸收氨气的物质的量为 mol;经进一步计算可求得W中CaCN2质量分数。
③上述实验所得结果明显偏小,若不考虑装置的气密性和操作误差,则导致结果偏小的可能原因是
(写1种)。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县高二下学期期末考试化学试卷(解析版) 题型:选择题
下列物质的熔点高低顺序,正确的是( )
A.金刚石>晶体硅>碳化硅B.K>Na>Li
C.NaF<NaCl<NaBr D.CI4>CBr4>CCl4>CH4
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县第二学期期中考试高一化学试卷(解析版) 题型:填空题
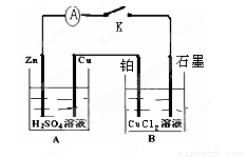
如下图,回答问题:
(1)A装置是将 能转化为 能。
(2)Zn是 极, 电极反应式为 ; Cu电极反应式为 ;
Pt是 极, 电极式为 ; 石墨电极反应式为 。
(3)电解一段时间后发现石墨电极增重6.4g,则外电路中通过的电子的物质的量是 摩尔,
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县第二学期期中考试高一化学试卷(解析版) 题型:选择题
化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是( )
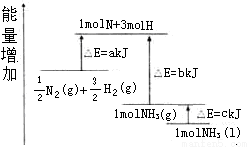
A.N2(g)+3H2(g)=2NH3(1);△H=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g)=2NH3(g);△H=2(b-a)kJ·mol-1
C. N2(g)+
N2(g)+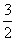 H2(g)=NH3(1);△H=(h+c-a)kJ·mol-1
H2(g)=NH3(1);△H=(h+c-a)kJ·mol-1
D. N2(g)+
N2(g)+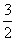 H2(g)=NH3(g);△H=(a+b)kJ·mol-1
H2(g)=NH3(g);△H=(a+b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县第二学期期中考试高一化学试卷(解析版) 题型:选择题
如图为元素周期表中短周期的一部分,其中b原子的最外层电子数为电子层数的两倍,则下列叙述中正确的是( )
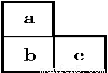
A.b的元素符号为C B.a元素的最高正化合价为+6
C.c元素的最高正化合价为+5 D.b元素的气态氢化物的化学式为H2S
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县第二学期期中考试高一化学试卷(解析版) 题型:选择题
下列化学式表示物质分子的是( )
A.氯化铵(NH4Cl) B.二氧化硅(SiO2) C.白磷(P4) D.硫酸钠(Na2SO4)
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省漳州市八校高三第四次联考理综化学试卷(解析版) 题型:简答题
(13分)没食子酸丙酯简称PG,结构简式为 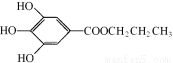 ,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂。
,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂。
⑴PG的分子式为 ,请写出PG分子中所含官能团的名称 ,1molPG与足量氢氧化钠溶液完全反应时,消耗的氢氧化钠的物质的量是 。
PG可发生如下转化:
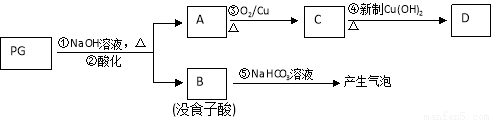
⑵A的结构简式为 ,1mol没食子酸最多可与 mol H2 加成。
⑶上图的有关变化中,属于氧化反应的有(填序号) 。
⑷从分子结构或性质上看,PG具有抗氧化作用的主要原因是(填序号) 。
A.含有苯环 B.含有羧基 C.含有酚羟基 D. 微溶于食用油
⑸反应④的化学方程式为:
⑹B有多种同分异构体,写出其中符合下列要求的同分异构体的结构简式:
i.含有苯环,且苯环上的一溴代物只有一种;ii.既能发生银镜反应,又能发生水解反应。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省宁德市高三5月质检理综化学试卷(解析版) 题型:简答题
(15分)氯化亚铜(CuCl)是一种白色固体,微溶于水,不溶于酒精。研究该物质的应用新领域、生产新方法及生产过程中的环保新措施都具有重要意义。
(1)镁—氯化亚铜海水电池,可用于鱼雷上。该电池被海水激活时,正极导电能力增强,同时产生气泡,则正极上被还原的物质有 、 (填化学式)。
(2)工业上以铜作催化剂,氯代甲烷和硅粉反应合成甲基氯硅烷的过程中产生大量废渣(主要成分为硅粉、铜、碳等)。某课外小组以该废渣为原料制CuCl,流程示意图如下:
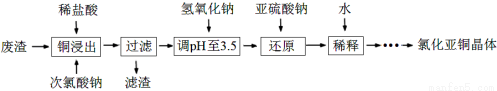
回答下列问题:
①氯代甲烷有4种,其中属于重要工业溶剂的是 (写出化学式)。
②“还原”阶段,SO32-将Cu2+还原得[CuCl2]-,完成下列离子方程式。
 Cu2++
Cu2++ Cl-+
Cl-+ SO32-+
SO32-+ =
= [CuCl2]-+
[CuCl2]-+ +
+
③在稀释过程中存在下列两个平衡:
ⅰ [CuCl2]- CuCl+Cl- K=2.32
CuCl+Cl- K=2.32
ⅱ CuCl(s) Cu+(aq)+Cl- Ksp=1.2×10-6
Cu+(aq)+Cl- Ksp=1.2×10-6
当[CuCl2]-完成转化时(c([CuCl2]-)≤1.0×10-5 mol·L-1),溶液中c(Cu+)≥ 。
④获得CuCl晶体需经过滤、洗涤、干燥。洗涤时,常用无水乙醇代替蒸馏水做洗涤剂的优点是 (写一点)。
(3)工业生产CuCl过程中产生浓度为2~3 g·L-1的含铜废水,对人及环境都有较大的危害,必须进行回收利用。用萃取法富集废水中的铜,过程如下:

①实验室完成步骤ⅰ时,依次在分液漏斗中加入曝气后的废水和有机萃取剂,经振荡并 后,置于铁架台的铁圈上静置片刻,分层。分离上下层液体时,应先 ,然后打开活塞放出下层液体,上层液体从上口倒出。
②写出步骤ⅱ的离子方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com