
下列物质的熔点高低顺序,正确的是( )
A.金刚石>晶体硅>碳化硅B.K>Na>Li
C.NaF<NaCl<NaBr D.CI4>CBr4>CCl4>CH4
D
【解析】
试题分析:A.金刚石、晶体硅、碳化硅都是原子晶体,原子半径越小,共价键的键长就越短,原子的结合力就越强,键能就越大,克服共价键使物质熔化或汽化消耗的能量就越大,物质的熔沸点就越高,由于共价键C-C<C-Si<Si-Si,所以熔点由高到低的顺序是:金刚石>碳化硅>晶体硅,错误;B.对于金属晶体来说,金属原子的半径越大,金属键就越弱,物质的熔沸点就越低,所以物质的熔点由高到低的顺序是:K<Na<Li,错误;C.物质都是离子晶体,对于离子晶体来说,离子半径越小,离子键的键长就越短,离子的结合力就越强,键能就越大,克服离子键使物质熔化或汽化消耗的能量就越大,物质的熔沸点就越高,由于离子半径F-<Cl-<Br-,所以熔点由高到低的顺序是:NaF>NaCl>NaBr,错误。D.这几种物质都是由分子构成的物质,结构相似,对于结构相似的物质来说,相对分子质量越大,分子间作用力就越大,物质的熔沸点就越高,所以熔点由高到低的顺序是:CI4>CBr4>CCl4>CH4。正确。
考点:考查各类晶体的熔沸点比较的知识。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源:2013-2014辽宁省高三仿真测试理科综合化学试卷(解析版) 题型:选择题
下列离子或分子在溶液中能大量共存,通入SO2后仍能大量共存的一组是
A.Na+ 、Mg2+、Cl-、ClO - B.NH3·H2O、SO32-、K+、Na+
C.Fe2+、Na+ 、K+、NO3- D.K+、Ca2+、Br-、Cl-
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三高考模拟理综化学试卷(解析版) 题型:填空题
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
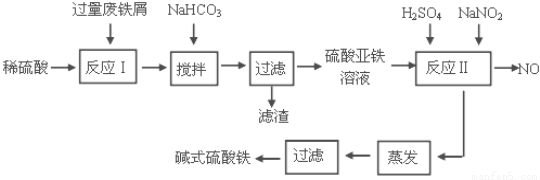
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在 范围内。
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为
。
(3)实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2体积为 11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为 。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(6)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:
则溶液中铁元素的总含量为 g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会
(填“偏高” “偏低” “不变”)
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州市高三5月综合练习理综化学试卷(解析版) 题型:选择题
基于实验现象的推论,你认为合理的是( )
选项 | 实验现象 | 推论 |
A | 乙烯气体可以使溴水褪色 | 乙烯发生取代反应 |
B | 浓硫酸电导率比较低 | 硫酸浓度大时是弱电解质 |
C | 氨气用于喷泉实验 | 氨气极易溶于水 |
D | 硝酸溶液使pH试纸先变红后变白 | 硝酸酸性太强不能用pH试纸检测 |
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县高二下学期期末考试化学试卷(解析版) 题型:选择题
向盛有硝酸银水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到无色的透明溶液,下列对此现象的说法正确的是( )
A.反应前后Ag+的浓度不变
B.沉淀溶解后,生成[Ag (NH3) 2] OH难电离
C.配合离子[Ag (NH3)2] + 存在离子键和共价键
D.配合离子[Ag (NH3)2] +中,Ag+提供空轨道,NH3给出孤对电子
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县高二下学期期末考试化学试卷(解析版) 题型:选择题
下列各项所述的数字不是6的是 ( )
A.在NaCl晶体中,与一个Na+最近的且距离相等的Cl- 的个数
B.在金刚石晶体中,最小的环上的碳原子个数
C.在二氧化硅晶体中,最小的环上的原子个数
D.在NaCl晶体中,与一个Cl-最近的且距离相等的Na+ 的个数
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县高二下学期期末考试化学试卷(解析版) 题型:选择题
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为( )
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县第二学期期中考试高一化学试卷(解析版) 题型:选择题
电解CuCl2和NaCl的混合溶液,阴极和阳极上最先分别析出的物质是( )
A.H2和Cl2 B.Cu和Cl2 C. H2和O2 D.Cu和O2
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:填空题
(共12分)(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出257.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
①反应的热化学方程式为 。
②又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g) △H=—24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=—47.4kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com