
A、B、C、D四种可溶性盐,分别由Na+、Ba2+、Cu2+、Ag+、CO32—、SO42—、Cl—、NO3—中的不同阳离子和阴离子各一种组成。现做以下实验:
① 将四种盐各取少量,分别溶于盛有5 mL蒸馏水的四支试管中,只有B盐溶液呈蓝色。
② 分别向4支试管中加入2 mL稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象。
根据上述事实,推断这四种盐的化学式分别为:
A B C D
科目:高中化学 来源: 题型:填空题
(1)将NaOH溶液滴入FeSO4溶液中,能观察到的现象是 。
(2)把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等。
则Fe粉和氯化铁的物质的量之比为________
(3)向40mL 1mol/L的NaOH溶液中通入过量的CO2,并将溶液分成两等份。
①一份加热、蒸干、灼烧,所得固体的化学式是 。
②将NaHSO4固体放入另一份溶液中,发生反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将FeCl3溶液与NH4SCN溶液混合发生如下反应
①Fe3++SCN- Fe(SCN)2+ K1="200" ②Fe(SCN)2++SCN-
Fe(SCN)2+ K1="200" ②Fe(SCN)2++SCN- Fe(SCN)2+ K2
Fe(SCN)2+ K2
红色 深红色
(1)已知:若起始c(Fe3+)、c(SCN-)均为0.001 mol/L,测得混合溶液中c(Fe3+)约为8.5×10-4 mol/L,c[Fe(SCN)2+]约为1.5×10-4 mol/L,c[Fe(SCN)2+]约为5×10-6 mol/L,则反应②的平衡常数K2为 。
(2)取两份混合溶液,分别向溶液中滴加同体积同浓度的FeCl3溶液与NH4SCN溶液,溶液颜色均加深,其原因是 。仔细观察,滴加NH4SCN溶液时,混合液颜色更深一些,其原因是 。
(3)向FeCl2与NH4SCN混合溶液中滴加酸化的H2O2溶液,溶液先变红,写出H2O2与Fe2+反应的离子方程式 ,继续滴加H2O2,溶液褪色,产生大量能够使澄清石灰水变浑浊的气体且硫氰根中氮元素全部转化为N2,向反应后的溶液中滴加BaCl2溶液,有不溶于稀盐酸白色沉淀生成。写出H2O2与SCN-反应的离子方程式 。
(4)为测定某溶液中c(Cl-),取待测液V1 mL,向其中加入V2 mL浓度为c2 mol/L的AgNO3溶液(过量),再加入少量铁铵矾[NH4Fe(SO4)2·12H2O]作指示剂,用NH4SCN标准溶液(浓度为c3 mol/L)滴定剩余的Ag+,消耗NH4SCN溶液体积为V3 mL。(已知Ag++SCN- = AgSCN↓(白色沉淀),Ksp(AgSCN)=4.9×10-13、Ksp(Ag Cl)=1.56×10-10)。请回答:
①在用NH4SCN标准溶液滴定前,应先通过过滤除去生成的AgCl,若不过滤,则测定结果将 。(填“偏高”,“偏低”或不变)。
②最终测得c(Cl-)= mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
围绕下列七种物质:①铝,②A12O3,③稀硝酸,④H2SO4,⑤Ba(OH)2固体,⑥氨水,⑦A12(SO4)3,根据要求回答下列问题。
(1)既能与强酸反应,又能与强碱反应的是 (填序号)。
(2)属于电解质的是 (填序号)。
(3)写出最适宜制取Al(OH)3的离子方程式 。
(4)两物质发生反应的离子方程式为H++OH—=H2O,请写出该反应的化学方程式 。
(5)34.2g⑦溶于水配成500mL溶液,溶液中SO42—的物质的量浓度为 。
(6)①与③发生反应的化学方程式为A1+4HNO3=A1(NO3)3+NO↑+2H2O,该反应中还原剂与氧化剂的物质的量之比是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。制备ClO2有下列两种方法:
方法一:2 NaClO3 + 4 HCl=2 ClO2↑+ Cl2↑+ 2 NaCl + 2 H2O
方法二:2 NaClO3 + H2O2 + H2SO4=2 ClO2↑+ O2↑+Na2SO4 + 2 H2O
(1)方法一的离子方程式: ;
(2)方法二中被氧化的物质是 ,若反应中有0.1mol电子转移,则产生的ClO2气体在标准状况下的体积为 L;在下面的化学式上标出电子转移的方向和数目2 NaClO3 + H2O2 + H2SO4=2 ClO2↑+ O2↑+ Na2SO4 + 2 H2O
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某混合溶液中可能大量含有的离子如下表所示:
| 阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 | Cl-、Br-、OH-、CO32-、AlO2- |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Ca2+、Ba2+、CO32-、SO42-. 现取三份各100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,收集到0.08mol气体;
第三份加入足量BaCl2 溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,沉淀质量为4.66g。
根据上述实验,回答以下问题:
(1)由第一份进行的实验推断该混合物是否一定含有Cl- : ,原因是 .
(2)由第二份进行的实验可知混合物中应含有 离子,其物质的量浓度为 .
(3)由第三份进行的实验可知12.54g 沉淀的成份为 。请计算形成该沉淀的原混合物中各离子的物质的量。(要求计算过程)
(4)综合上述实验,你认为以下结论正确的是
| A.该混合物中一定含有K+、NH4+、CO32-、SO42-,可能含有Cl-,且n(K+)≥0.04mol |
| B.该混合物中一定含有NH4+、CO32-、SO42-,可能含有Ca2+、 K+、Cl- |
| C.该混合物中一定含有NH4+、CO32-、SO42-,可能含有K+、Cl- |
| D.该混合物中一定含有NH4+、SO42-,可能含有Ca2+、K+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在Na+浓度为0.5mol/L的某澄清溶液中,还可能含有下表中的若干种离子: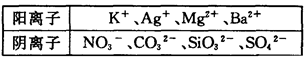
取该溶液100mL进行如下实验(气体体积在标准状况下测定):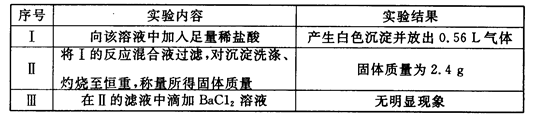
试回答下列问题:
(1)实验Ⅰ能确定一定不存在的阳离子是____________。
(2)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)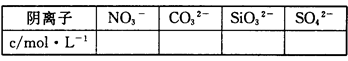
(3)判断K+是否存在,若存在求其最小浓度,若不存在说明理由_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知4℃时四种化合物在水中和液氨中的溶解度如下表:
| | AgNO3 | Ba(NO3)2 | AgCl | BaCl2 |
| H2O(液) | 170g | 9.2g | 1.5×10-4g | 33.3g |
| NH3(液) | 86g | 97.2g | 0.8g | 0g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com